- Canalización de sustratos
-
Se conoce por canalización de sustratos o channeling al proceso de transferencia directa de un intermediario metabólico entre los sitios activos de dos enzimas que catalizan reacciones secuenciales en una ruta biosintética. En estos casos, el producto de la enzima formado en una reacción catalítica en un sitio activo es sustrato para otra reacción en otra enzima o sitio activo distal, sin ser liberado en disolución.
Contenido
Ventajas de la canalización
La canalización de sustratos presenta una serie de ventajas, como son:
- Evita la liberación de intermediarios inestables de las reacciones protegiéndolos de descomposición por el medio externo acuoso.
- Puede hacer que una ruta metabólica sea más rápida y eficiente de lo que sería si las enzimas estuvieran aleatoriamente distribuidas en el citosol al reducir el tiempo de tránsito de intermediarios.
- Previene la pérdida de intermediarios por difusión. Esto puede ser especialmente importante en casos de especies neutras, como el indol, que podría escapar de la célula por difusión pasiva a través de las membranas celulares.
- Evita el fenómeno de competencia. Prevenir la entrada de intermediarios en rutas metabólicas competidoras, protegiéndolos de ser tomados como sustratos y ser consumidos por reacciones competidoras catalizadas por otras enzimas.
- En caso de que los metabolitos intermediarios fuesen tóxicos para la célula quedan secuestrados dentro del ambiente del complejo multienzimático hasta quedar convertidos en un sustrato final no tóxico.
Mecanismos moleculares
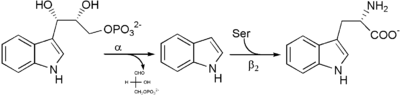 La triptófano sintasa, primer tunnelling descrito. Enzima, tetrámero α2β2, aislado en E. coli que cataliza el paso final de biosíntesis del triptófano. Las diferentes unidades catalizan pasos separados. Las α convierten indol 3-glicerofosfato en indol y gliceraldehido-3-P, mientras el dímero-β2 cataliza la condensación de indol y serina para dar triptófano. Sin embargo, el tetrámero α2β2 es de 30 a 100 veces más activo que las subunidades aisladas, ya que el intermediario pasa por un túnel intramolecular sin ser liberado.
La triptófano sintasa, primer tunnelling descrito. Enzima, tetrámero α2β2, aislado en E. coli que cataliza el paso final de biosíntesis del triptófano. Las diferentes unidades catalizan pasos separados. Las α convierten indol 3-glicerofosfato en indol y gliceraldehido-3-P, mientras el dímero-β2 cataliza la condensación de indol y serina para dar triptófano. Sin embargo, el tetrámero α2β2 es de 30 a 100 veces más activo que las subunidades aisladas, ya que el intermediario pasa por un túnel intramolecular sin ser liberado.
La cristalografía de rayos x en complejos enzimáticos ha revelado varios mecanismos moleculares para el channeling:
- Efecto túnel o tunneling. El primer mecanismo molecular descrito en la canalización de sustratos fue el descubrimiento de un túnel intramolecular en triptófano sintasa. Dos sitios activos están conectados por un túnel intramolecular que atraviesa la estructura de la proteína; los sustratos de la reacción son traslocados a través de él de un sitio catalítico a otro. Determinaciones de estructura han puesto de manifiesto evidencias de tunneling de amoníaco y carbamato en carbamoil-fosfato sintasa (CPS) y de amoníaco en fosforibosilpirofosfato amidotransferasa (GPATasa).
- Canalización electrostática o electrostatic channeling. Mediante el desplazamiento sobre la superficie de las enzimas del complejo a través de “caminos electrostáticos” creados por las cadenas laterales de los aminoácidos. Esta región cargada en la superficie del enzima actúa como camino o “autopista electrostática” para guiar al sustrato con carga opuesta de un sitio activo al otro. Esto se vio en la enzima bifuncional dihidrofolato reductasa-timidilato sintasa. Su estructura no mostraba evidencia de un túnel entre los sitios activos ni éstos se encuentran adyacentes. Sin embargo, había residuos cargados positivamente a lo largo de la superficie entre los sitios activos formando una autopista electrónica suficiente para canalizar el dihidrofolato cargado negativamente con gran eficiencia.
- Brazos oscilantes o swinging arms. Observada en el complejo piruvato decarboxilasa cuando un sustrato es unido a un brazo flexible que se mueve entre varios sitios activos. Estos grupos prostéticos covalentemente unidos o brazos oscilantes, y sus dominios proteicos asociados, son esenciales para el mecanismo de acoplamiento de sitio activo y canalización de sustrato en parte de los sistemas multifuncionales enzimáticos responsables. Estos dominios proteicos, para los cuales la maquinaria postraduccional en la célula es altamente específica, son cruciales, contribuyendo a los procesos de reconocimiento molecular que delimitan y protegen los sustratos y los intermediarios catalíticos. Los dominios tienen nuevos pliegues y se mueven gracias a regiones de unión flexibles que los amarran a otros componentes de sus respectivos complejos multienzimáticos.
Estructura y cinética
Entre estas enzimas canalizadoras se encuentran características cinéticas y estructurales comunes. Los sitios activos pueden estar localizados bien en dominios separados en una enzima multifuncional o en subunidades separadas en un complejo multienzimático estable.
Cuando varias enzimas consecutivas en un canal de una ruta metabólica son sustratos entre sí mismas se habla de metabolón. El metabolón es un complejo estructural y funcional temporal formado entre enzimas secuanciales de una ruta metabólica, unidas por interacciones no covalentes, y elementos estructurales de la célula tales como proteínas intregales de membrana y proteínas del citoesqueleto. La formación de metabolones permite el channeling de intermediarios metabólicos de una enzima directamente como sustrato en el sitio activo de la enzima consecutiva de la vía metabólica. El ciclo de Krebs es un ejemplo de metabolón que facilita el channeling.
Una comparación de los resultados estructurales y cinéticos revela que estas enzimas y sus sitios activos frecuentemente muestran interacciones alostéricas que sincronizan las reacciones individuales promoviendo una canalización eficiente que previene el acumulo de exceso de intermediario y su pérdida en disolución. El alosterismo hace referencia a que las estructuras cuaternarias de las proteínas pueden adoptar múltiples formas. El comportamiento de una enzima alostérica depende de los cambios de conformación según dos modelos, el concertado donde la conformación de todas las subunidades cambia simultáneamente y el secuencial donde el cambio de una subunidad facilita que otra cambie su conformación.
Así pues el channeling o canalización es una característica general de procesos bioquímicos en los que participan complejos enzimáticos. Un gran número de enzimas forman complejos estables o transitorios y muestran channeling o transferencia directa de intermediarios.
Véase también
Bibliografía
- Miles EW, Rhee S, Davies DR (April 1999). The molecular basis of substrate channeling. J. Biol. Chem. 274 (18): 12193–6. doi: 10.1074/jbc.274.18.12193 [1]. PMID 10212181 (http://www.ncbi.nlm.nih.gov/pubmed/10212181).
- Huang X, Holden HM, Raushel FM (2001). Channeling of substrates and intermediates in enzyme-catalyzed reactions. Annu. Rev. Biochem. 70: 149–80. doi: 10.1146/annurev.biochem.70.1.149 [2]. PMID 11395405 .
- Perham RN (2000). Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions. Annu. Rev. Biochem. 69: 961–1004. doi: 10.1146/annurev.biochem.69.1.961 [3]. PMID 10966480 .
Wikimedia foundation. 2010.
