- Clorato de zinc
-
Clorato de zinc
Nombre (IUPAC) sistemático trioxoclorato (V) de zinc General Fórmula semidesarrollada Zn(ClO3)2 Fórmula estructural 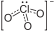 + Zn2++
+ Zn2++ 
Fórmula molecular n/d Identificadores Número CAS 10361-95-2 Propiedades físicas Estado de agregación sólido cristalino incoloro, blanco o amarillo Apariencia cristales higroscópicos Densidad 2,5 kg/m3; 2500 g/cm3 Masa molar 232.29 g/mol Punto de fusión 333 K (60 °C) Propiedades químicas Solubilidad en agua muy soluble en agua Compuestos relacionados Otros cationes clorato de sodio
clorato de potasio
clorato de cobre (II)Otros aniones sulfato de zinc
nitrato de zinc
carbonato de zincOtros compuestos de Zn y Cl cloruro de zinc
clorito de zinc
hipoclorito de zincRiesgos Inhalación Daños en nariz y garganta Piel Daños y quemaduras Ojos Daños y quemaduras Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasClorato de zinc (Zn(ClO3)2) es un compuesto químico inorgánico que actúa como agente oxidante.
Contenido
Usos
Se usa como catalizador de reacciones orgánicas y en la fabricación de adhesivos, colorantes y explosivos.
Reactividad
Forma mezclas inflamables con materiales combustibles; estas mezclas pueden ser explosivas si el material combustible está finamente dividido. En contacto con ácido sulfúrico concentrado puede causar incendios o explosiones. También es potencialmente explosivo al mezclarse con sales amónicas, metales en polvo, carbón, silicio, azufre o sulfuros. Por ejemplo, al combinarse con aluminio finamente dividido puede explotar por calentamiento, percusión o fricción.[1]
Al calentarlo con un ácido orgánico diprótico húmedo libera óxido de cloro y dióxido de carbono.[2]
Riesgos
Es muy oxidante por lo que reacciona explosivamente con hidrocarburos y otros combustibles (madera, papel, gasolina, tejidos). Puede explotar al calentarse. Reaviva el fuego de una sustancia que arde.
Una persona expuesta intensivamente al clorato de zinc puede desarrollar enfermedades respiratorias. Los trabajadores que están en contacto con zinc en el lugar de trabajo sufren la llamada gripe del metal, una reacción de hipersensibilidad que desaparece en pocos días.[3]
Referencias
- ↑ Cameo chemicals http://cameochemicals.noaa.gov/chemical/1715
- ↑ Bretherick, L. Handbook of Reactive Chemical Hazards, 2nd ed., Butterworths: Boston, MA., 1979. pág. 100 y 806
- ↑ Cinc (Zn) Propiedades químicas y efectos sobre la salud y el medio ambiente
Categorías:- Cloratos
- Compuestos de zinc
Wikimedia foundation. 2010.
