- Mol
-
mol
mol Estándar: Unidades básicas del Sistema Internacional Magnitud: Cantidad de sustancia Símbolo: mol Expresada en: 1 mol = Cantidad: 6,022 141 79 (30) × 1023 El mol (símbolo: mol) es la unidad con que se mide la cantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
Dada cualquier sustancia (elemento químico, compuesto o material) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como átomos hay en 12 gramos de carbono-12. Esta definición no aclara a qué se refiere con cantidad de sustancia y su interpretación es motivo de debates,[1] aunque normalmente se da por hecho que se refiere al número de entidades.
El número de unidades elementales –átomos, moléculas, iones, electrones, radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro (NA)[2] y equivale a:
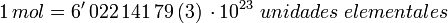
Contenido
Historia
Dado el tamaño extremadamente pequeño de las unidades fundamentales, y su número inmensamente grande, es imposible contar individualmente las partículas de una muestra. Esto llevó a desarrollar métodos para determinar estas cantidades de manera rápida y sencilla.
Si tuviésemos que crear una unidad de cantidad de sustancia hoy en día, seguramente se utilizaría la "Tera-partícula" (1012 partículas) o algo similar. Sin embargo, dado que el mol se ha definido hace ya tiempo y en otro contexto de investigación, se han utilizado diferentes métodos. El primer acercamiento fue el de Joseph Loschmidt, intentando contabilizar el número de moléculas en un centímetro cúbico de sustancias gaseosas bajo condiciones normales de presión y temperatura.
Los químicos del siglo XIX usaron como referencia un método basado en el peso y decidieron utilizar unos patrones de masa que contuviesen el mismo número de átomos o moléculas. Como en las experiencias de laboratorio se utilizan generalmente cantidades del orden del gramo, definieron los términos átomo-gramo, molécula-gramo, fórmula-gramo, etc. Actualmente estos términos no se usan y han sido sustituidos por el mol.
Más adelante el mol queda determinado como el número de moléculas H2 existentes en dos gramos de hidrógeno, lo que da el peculiar número de 6,022 141 79 (30) × 1023 al que se conoce como número de Avogadro.
Aclaraciones
Dado que un mol de moléculas H2 equivalen a 2 gramos de hidrógeno, un mol de átomos H será entonces un gramo de este elemento. O sea que en un gramo de hidrógeno hay 6,022 141 79 (30) × 1023 átomos.
Para evitar ambigüedades, en el caso de sustancias macroelementales conviene por lo tanto indicar, cuando sea necesario, si se trata de átomos o de moléculas. Por ejemplo: "un mol de moléculas de nitrógeno" (N2) equivale a 28 g de nitrógeno. O, en general, especificar el tipo de partículas o unidades elementales a que se refiere.
El mol se puede aplicar a las partículas, incluyendo los fotones, cuya masa es nula. En este caso, no cabe establecer comparaciones basadas en la masa.
En los compuestos iónicos también puede utilizarse el concepto de mol, aun cuando no están formados por moléculas discretas. En ese caso el mol equivale al término fórmula-gramo. Por ejemplo: 1 mol de NaCl (58,5 g) contiene NA iones Na+ y NA iones Cl–, donde NA es el número de Avogadro.
- Por ejemplo para el caso de la molécula de agua
- Se sabe que en una molécula de H2O hay 2 átomos de hidrógeno y un átomo de oxígeno.
- Se puede calcular su Mr(H2O) = 2 × Ar(H) + Ar(O) = 2 × 1 + 16 = 18, o sea Mr(H2O) = 18 uma
- Se calcula la masa molecular absoluta = 18 × 1,66 × 10-24g = 2,99 × 10-23g
- Se conoce su masa molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de O)
- En un mol de agua hay 6,022 141 79 (30) × 1023 moléculas de H2O, a la vez que:
- En un mol de agua hay 2 × 6,022 141 79 (30) × 1023 átomos de H (o sea 2 moles de átomos de hidrógeno) y 6,022 141 79 (30) × 1023 átomos de O (o sea 1 mol de átomos de oxígeno)
Equivalencias
- 1 mol es equivalente a 6,022 141 79 (30) × 1023 unidades elementales
- La masa de un mol de sustancia, llamada masa molar, es equivalente a la masa atómica o molecular (según se haya considerado un mol de átomos o de moléculas) expresada en gramos.
- 1 mol de gas ideal ocupa un volumen de 22,4 L a 0 ºC de temperatura y 1 atm de presión; y de 22,7 L si la presión es de 1 bar (0,9869 atm).
Véase también
- Estequiometría
- Masa molar
- Número de Avogadro
- Unidad de masa atómica
- Volumen molar
- Constante universal de los gases ideales
Referencias
- ↑ Se busca una magnitud para la unidad mol
- ↑ CODATA (2006): Avogadro constant, NIST.
Categorías: Unidades básicas del Sistema Internacional | Unidades de masa | Estequiometría | Equilibrio químico | Magnitudes químicas
Wikimedia foundation. 2010.
