- Ecuación de Van't Hoff
-
Ecuación de Van't Hoff
La ecuación de Van't Hoff en termodinámica química relaciona la variación de la temperatura absoluta (T) con la variación de la constante de equilibrio (K) dado por la diferencia de entalpía (ΔH). Esta ecuación fue propuesta inicialmente por Jacobus Henricus van 't Hoff.
Si se asume que el calor de reacción no varía con la temperatura, la resolución de esta ecuación diferencial conduce a lo siguiente:
En esta ecuación
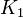 es la constante de equilibrio a la temperatura absoluta
es la constante de equilibrio a la temperatura absoluta 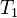 y
y 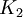 es la constante de equilibrio a la temperatura absoluta
es la constante de equilibrio a la temperatura absoluta 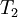 .
. 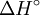 es la variación de entalpía y
es la variación de entalpía y 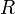 es la constante de los gases.
es la constante de los gases.Considerando las relaciones entre la energía libre de Gibbs y la constante de equilibrio (
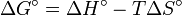 y
y 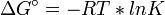 ), la ecuación también se podría escribir de la siguiente manera:
), la ecuación también se podría escribir de la siguiente manera:Por tanto, al representar valores de logaritmo natural de la constante de equilibrio medidos para cierto equilibrio versus el inverso de la temperatura se obtiene una línea recta, cuya pendiente negativa es igual a la variación de la entalpía dividida entre la constante de los gases, y la ordenada en el origen es igual a la variación de entropía
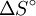 dividida entre la constante de los gases.Categorías: Ecuaciones | Termoquímica
dividida entre la constante de los gases.Categorías: Ecuaciones | Termoquímica
Wikimedia foundation. 2010.

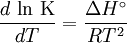
![\ln \left( {\frac{{K_2 }}{{K_1 }}} \right) = \frac{{ \Delta H^\circ }}{R}\left[ {\frac{1}{{T_1 }} - \frac{1}{{T_2 }}} \right]](/pictures/eswiki/98/b57a8989b82779b35a96c28e17c650f0.png)
![\ln \left( K \right) = - \frac{{\Delta H^\circ }}{R}\left[ {\frac{1}{{T }}}\right] + \frac{{\Delta S^\circ }}{R}](/pictures/eswiki/48/080feb6c106bd4023223d212dedc79de.png)