- Esterificación de Fischer-Speier
-
Esterificación de Fischer-Speier
La esterificación de Fischer-Speier o esterificación de Fischer es un tipo especial de esterificación que consiste en la formación de un éster por reflujo de un ácido carboxílico y un alcohol, en presencia de un catalizador ácido. La reacción fue descrita por vez primera por Emil Fischer y Arthur Speier en 1895.[1] La mayoría de ácidos carboxílicos son aptos para la reacción, pero el alcohol debe ser generalmente un alcohol primario o secundario. Los alcoholes terciarios son susceptibles a la eliminación, y los fenoles suelen ser muy poco reactivos para dar rendimientos útiles. Los catalizadores más comúnmente usados para una esterificación de Fischer incluyen al ácido sulfúrico, ácido tósico y un ácido de Lewis como el triflato de escandio(III). Para sustratos más valiosos o sensibles (por ejemplo, biomateriales), suele usarse DCC. La reacción suele llevarse a cabo sin un solvente, particularmente cuando hay un gran exceso de reactante, o en un solvente no polar. Los tiempos de reacción comunes varían de 1 a 10 horas a temperaturas de 60-110°C.
La acilación directa de los alcoholes con ácidos carboxílicos es preferida sobre las acilaciones con anhídrido (economía de átomos pobre) o cloruro de acilo (sensible a la humedad). La principal desventaja de la acilación directa es el equilibrio químico desfavorable, que debe ser remediado, por ejemplo, por un gran exceso de uno de los reactantes, o por eliminación del agua (por ejemplo, mediante la destilación de Dean-Stark, el uso de tamices moleculares, o el uso de una cantidad estequiométrica de ácido sulfúrico concentrado como catalizador). En un estudio[2] se encontró que el TBATB es un catalizador muy efectivo. Por ejemplo, la acilación del 3-fenilpropanol con ácido acético glacial y TBATB a reflujo genera el éster en 15 minutos en un rendimiento químico del 75%, sin la necesidad de eliminar agua. Se cree que el ácido bromhídrico liberado por el TBATB protona al alcohol sobre el ácido, haciendo que el carboxilato sea el nucleófilo real en un mecanismo "inverso" al de la esterificación normal.
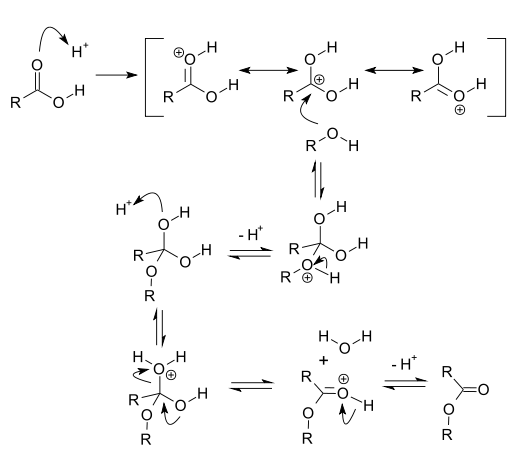
Mecanismo
El mecanismo de reacción para esta reacción tiene varios pasos:
- Se transfiere un protón del catalizador ácido al oxígeno del grupo carbonilo carboxílico, incrementando el carácter electrófilo del carbono carbonílico.
- El carbono carbonílico es, a continuación, atacado por el átomo de oxígeno nucleofílico del alcohol.
- Se transfiere un protón del catión oxonio a una segunda molécula de alcohol, dando lugar a un complejo activado.
- La protonación de uno de los grupos hidroxilo del complejo activado conduce a un nuevo ion oxonio.
- La pérdida de agua del último ion oxonio, y la posterior deprotonación da lugar al éster.
Un mecanismo general para una esterificación de Fischer se muestra a continuación.
Referencias
- ↑ Emil Fischer, Arthur Speier (1895). «Darstellung der Ester» Chemische Berichte. Vol. 28. pp. 3252–3258. DOI 10.1002/cber.189502803176.
- ↑ Tetrabutylammonium tribromide mediated condensation of carboxylic acids with alcohols Sarala Naik, Veerababurao Kavala, Rangam Gopinath, and Bhisma K. Patel Arkivoc 2006 (i) 119-127 Artículo en línea
Categoría: Reacciones químicas orgánicas
Wikimedia foundation. 2010.