- Esterificación
-
Esterificación
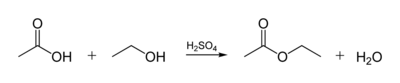
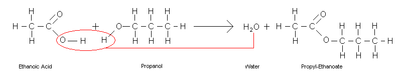
Se denomina esterificación al proceso por el cual se sintetiza un éster. Un éster es un compuesto derivado formalmente de la reacción química entre un ácido carboxilico y un alcohol.
Comúnmente cuando se habla de ésteres se hace alusión a los ésteres de ácidos carboxílicos, substancias cuya estructura es R-COOR', donde R y R' son grupos alquilo. Sin embargo, se pueden formar en principio ésteres de prácticamente todos los oxácidos.
Contenido
Producción de ésteres
La industria química produce grandes cantidades de ésteres, centenares de millones de kilogramos por año. Son de especial importancia el acetato de etilo, el acetato de butilo, el ftalato de dibutilo, el acetato de celulosa, el xantogenato de celulosa, el trinitrato de glicerilo, el acetato de vinilo y el nitrato de celulosa.
El salicilato de metilo es un éster que se emplea principalmente como agente aromatizante y posee la ventaja de que se absorbe a través de la piel. Una vez absorbido, el salicilato de metilo puede hidrolizarse a ácido salicílico, el cual actúa como analgésico. Este producto puede extraerse de varias plantas medicinales.
El ácido acetilsalicílico o aspirina, como es conocido comercialmente, es el más popular de los medicamentos sintéticos, debido a su acción analgésica, antipirética, anti-inflamatoria y antirreumática, y por ser utilizado en la prevención y tratamiento del infarto agudo al miocardio, además de su bajo coste.
La benzocaína o p-aminobenzoato de etilo es un anestésico local, empleado como calmante del dolor, obtenido también por esterificación.
Química de la esterificación
Dada la importancia de los ésteres se han desarrollado muchos procesos para obtener ésteres. El más común es el calentamiento de una mezcla del alcohol y del ácido correspondiente en presencia de cantidades catalíticas de ácido sulfúrico, utilizando el reactivo más económico en exceso para aumentar el rendimiento de la reacción (esterificación de Fischer-Speier). El ácido sulfúrico sirve en este caso tanto de catalizador como de sustancia higroscópica que absorbe el agua formada en la reacción (a veces es sustituido por ácido fosfórico concentrado). En general, este procedimiento requiere de temperaturas elevadas y de tiempos de reacción largos presentando por tanto inconvenientes; El alcohol puede sufrir reacciones de eliminación formando olefinas, esterificación con el propio ácido sulfúrico o la formación del correspondiente éter simétrico. De igual modo el ácido orgánico que se pretende esterificar puede sufrir descarboxilación.
Por esto a menudo se utilizan derivados del ácido más activos. En la síntesis del ácido acetilsalicílico por ejemplo (el éster entre el grupo hidroxilo del ácido salicílico y del ácido acético) se parte del anhidruro del ácido acético y del ácido salicílico que actúa como alcohol. En vez de agua se libera una molécula de ácido acético que puede ser separada fácilmente del producto:
O(OCCH3)2 + HO(C6H4)COOH -> HOOCCH3) + H3CCOO(C6H4)COOH
Otro proceso es la utilización del cloruro del ácido (R-COCl)(variante de Einhorn) y el alcohol en la presencia de piridina. En este caso se libera clorhídrico que reacciona directamente con la piridina del medio para dar el hidrocloruro de piridina. Las condiciones de esta reacción son muy suaves ya que no requiere la presencia de ácidos o bases fuertes y se puede llevar a cabo a temperatura ambiente o incluso inferior. Por esto permite la síntesis de compuestos en presencia de grupos funcionales muy sensibles.
También se utilizan procesos de transesterificación donde se hace reaccionar un éster con un alcohol en presencia de un catalizador como el tetracloruro de germanio, otro ácido de Lewis o trazas de base. Se libera el alcohol previamente unido en forma del éster. Este proceso se emplea industrialmente sobre todo en la obtención del PET (polietilentereftalato), un plástico transparente que se emplea por ejemplo para fabricar botellas de bebida.
Existen aún procesos de menor importancia como la adición de un ácido a una olefina, etcétera, que igualmente forman ésteres.
Mecanismo químico
La reacción de la esterificación pasa por un ataque nucleofílico del oxígeno de una molécula del alcohol al carbono del grupo carboxílico. El protón migra al grupo hidroxilo del ácido que luego es eliminado como agua. El rol del catalizador es el de aumentar la actividad carbonílica (la carga parcial positiva sobre el átomo de carbono) por protonación de uno de los oxígenos del ácido. Lo mismo se puede conseguir utilizando derivados más activos del ácido como los haluros o los anhidruros.
Propiedades de los ésteres
Se suele tratar de sustancias incoloras e hidrofóbicas (no se mezclan con el agua). Los ésteres de bajo peso molecular suelen tener un olor característico. Muchos aromas naturales de plantas son ésteres y otro sintéticos se emplean como aromas artificiales (el acetato de isoamilo tiene aroma a plátano, mientras que el hexanoato de alilo tiene aroma a piña).
Los ésteres tienen buenas propiedades como disolventes y a menudo se utilizan como tal (acetato de etilo).
Véase también
- Acetilación
- Acilación
- Hidrólisis
- Saponificación
- Transesterificación
Categoría: Reacciones químicas orgánicas
Wikimedia foundation. 2010.