- Complejo GARP
-
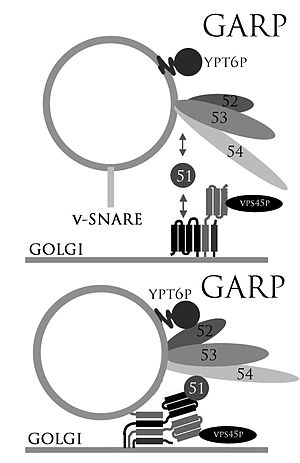
El GARP (Golgi Associated Retrograde Protein Complex) formado por cuatro proteínas denominadas Vps (Vacuolar Protein Sorting) 51, 52, 53 y 54 es muy importante en el transporte intracelular entre compartimentos. En un fraccionamiento celular se demuestra que estas proteínas se encuentran incluídas en membranas, nunca en el citosol. De la misma manera se ha demostrado que este complejo actúa mayoritariamente entorno al núcleo.[1]
La vía de transporte en la que actúa el complejo GARP es la que recicla las hidrolasas ácidas desde los lisosomas hasta al Golgi. La función de este complejo consiste en amarrar físicamente las vesículas al orgánulo de destino, en este caso el Golgi.
Cada compartimento es una proteína de ligadura que interacciona de forma selectiva y no covalente con una proteína o complejo proteico. Contribuyen a la especificad de los eventos de fusión de membranas ya que este proceso implica un acoplamiento altamente regulado y especifico entre los intermediarios de transporte.
En estudios con Saccharomyces Cervevisiae se ha hallado que el complejo GARP interacciona con las proteínas SNARE uniendo así vesícula con orgánulo y facilitando su fusión. Se ha demostrado que la proteína SNARE Syntaxin 10 es la proteína de unión de la Vps52 del complejo GARP.[2]
Contenido
Subunidades
VPS51
La VPS1 participa fundamentalmente en el transporte retrógrado, el movimiento definido de las vesículas de membranas asociadas desde endosomas de vuelta a la red trans-Golgi donde son recicladas para recorridos de transporte más lejanas. Este proceso se lleva a cabo gracias a la interacción entre el Vps51 del complejo de VFT(Vps53-Vacuolar protein sorting Fifty-Three)/GARP y la SNARE Tlg1p, que forma parte del complejo SNARE que fusiona las membranas. Sorprendentemente, aunque tanto el Vps51 como el SNARE Tlg1p son requeridos para este tipo de transporte, la eliminación de las secuencias de Tlg1p del Vps51 no bloquea el trafico, o sea que esta interacción particular no es crucial para la fusión de membranas
Otras funciones de esta proteína son el crecimiento de las microvellosidades de las células apicales durante la reproducción celular, regulación del tamaño celular, la organización vesicular y biogénesis, y la selección de proteínas para las vacuolas, proceso de dirección de proteínas hacia una vacuola, normalmente usando señales contenidas en la proteína.[3]
VPS52
Esta subunidad del complejo GARP es tan imprescindible como las demás para el buen funcionamiento de la proteína. Contiene 723 aminoácidos y tiene una masa aproximada de 82221 daltons. A diferencia de otras proteínas de este complejo se ha secuenciado totalmente y es de las que participa en la unión con la proteína SNARE Syntaxin 10 y la Rab06 para la fusión de vesícula con Golgi.[4]
VPS53
La función que lleva a cabo en el complejo es posibilitar la conexión de la vesícula mediante el t-SNARE TGL1 a Golgi, llevando a la fusión de membranas entre el TGN y los endosomas.[5] [6] [7]
A partir de un estudio realizado por las universidades de Yale y California[8] en mayo de 2010 se consiguió cristalizar un fragmento C-terminal de la Vps53 y observar cómo se plegaba en un domino único compuesto por dos paquetes α-helicoidal adyacentes. Además, se pudo identificar una superficie que podría tener un papel importante en el reconocimiento vesicular, puesto que mutaciones en esta superficie tuvieron como resultado defectos en el tráfico de membranas.
VPS54
Esta subunidad se puede dividir en regiones o dominios N y C terminales que tienen funciones diferentes. Mientras que el terminal N del Vps54 es importante para el montaje y la estabilidad del complejo GARP, el dominio terminal C conservado funciona como mediador en la localización de un compartimento endocítico temprano. La mutación del dominio C no tiene ningún efecto sobre el transporte retrógrado entre el aparato de Golgi y los endosomas tardíos. Sin embargo, cuando el reciclaje de los endosomas por el aparato de Golgi está bloqueado a causa de una mutación en el dominio N se observa un defecto específico en la recuperación de Snc1 desde los endosomas tempranos. Existe una hipótesis que defiende que la mutación la proteína Vps54 puede inducir a enfermedades neurodegenerativas tales como la ELA (Esclerosis Lateral Amiotrófica). Esto es defendido por un estudio realizado con un ratón , y las similitudes entre el complejo GARP de ratón y humano hace que no se descarte un efecto motoneurodegenerativo en humanos debido a una reducción de la actividad de amarre del complejo GARP.[9]
Algunos datos sugieren que los diferentes dominios determinan el movimiento de los complejos entrelazados por diferentes compartimentos para regular vías específicas del metabolismo celular.
Referencias
- ↑ H. Liewen, I. Meinhold- Heerlin, V. Oliveira, R. Schwarzenbacher et al. " Characterization of the human GARP (Golgi associated retrograde protein) complex." 306 (2005) 24-35.
- ↑ F. J. Perez-Victoria, G. Abascal-Palacios, I. Tascon, A. Kajava, J. G. Magadan, E. P. Pioro, J. S. Bonifacino, A. Hierro. "Structural basis for the wobbler mouse neurodegenerative disorder caused by mutation in the Vps54 subunit of the GARP complex". Proceedings of the National Academy of Sciences, 2010
- ↑ Siniossoglou S., Pelham H.R.B.J. "Vps51p links the VFT complex to the SNARE Tlg1p" Biol. Chem. 277:48318-48324(2002)
- ↑ Conibear E., Stevens T.H. "Vps52p, Vps53p, and Vps54p form a novel multisubunit complex required for protein sorting at the yeast late Golgi." Mol. Biol. Cell 11:305-323(2000)
- ↑ Siniossoglou S., Pelham H.R.B.EMBO J. "An effector of Ypt6p binds the SNARE Tlg1p and mediates selective fusion of vesicles with late Golgi membranes." 20:5991-5998(2001)
- ↑ Reggiori F., Wang C.-W., Stromhaug P.E., Shintani T., Klionsky D.J. J " Vps51 is part of the yeast Vps fifty-three tethering complex essential for retrograde traffic from the early endosome and Cvt vesicle completion.". Biol. Chem. 278:5009-5020(2003)
- ↑ Conibear E., Cleck J.N., Stevens T.H. "Vps51p mediates the association of the GARP (Vps52/53/54) complex with the late Golgi t-SNARE Tlg1p."Mol. Biol. Cell 14:1610-1623(2003)
- ↑ Neil Vasana, Alex Hutagalungb, Peter Novickb, and Karin M. Reinischa. "Structure of a C-terminal fragment of its Vps53 subunit suggests similarity of Golgi-associated retrograde protein(GARP) complex to a family of tethering complexes". Department of Cell Biology, Yale University School of Medicine, New Haven, CT 06520; and Department of Cellular and Molecular Medicine, University of California, La Jolla, CA 92093
- ↑ Quenneville NR, Chao TY, McCaffery JM, Conibear E. "Domains within the GARP subunit Vps54 confer separate functions in complex assembly and early endosome recognition" . Mol Biol Cell. 2006 Apr;17(4):1859-70
Categoría:- Proteínas
Wikimedia foundation. 2010.