- Condensación benzoínica
-
La condensación benzoínica es una reacción (a menudo denominada como una reacción de condensación, por razones históricas) entre dos aldehídos aromáticos, especialmente el benzaldehído. La reacción es catalizada por un nucleófilo, como el anión cianuro o un carbeno N-heterocíclico. El producto de la reacción es una aciloína aromática del tipo de la benzoína (PhCO-COPh).[1] Una primera versión de la reacción fue desarrollada en 1832 por Justus von Liebig y Woehler Friederich durante su investigación sobre el aceite de almendra amarga.[2] La versión catalítica de la reacción fue desarrollado por Nikolai Zinin a finales de 1830,[3] [4] y el mecanismo de reacción para esta reacción orgánica fue propuesto en 1903 por AJ Lapworth.[5]
Mecanismo de reacción
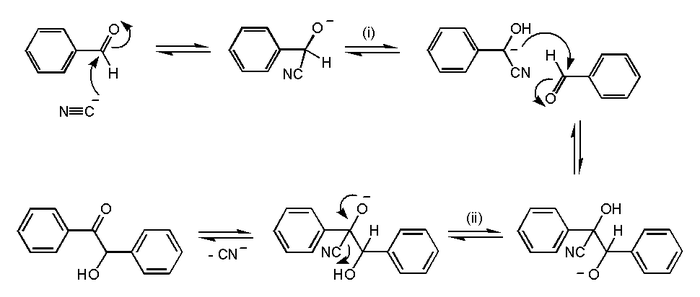
En el primer paso de la reacción, el anion cianuro (Por lo general cianuro de sodio) reacciona con el aldehído en una adición nucleofílica, formando el anión de la cianohidrina (Véase Cianohidrina) como está mostrado en el Esquema 1. Por un equilibrio ácido base, se obtiene la inversión de polaridad del grupo carbonilo, generándose un anión en la posición α que luego se adiciona al segundo grupo carbonilo, dándose una reacción similar a la condensación aldólica. La reacción concluye con una transferencia de protones, eliminación del cianuro y una tautomería ceto-enólica. Se trata de una reacción reversible.
El ion cianuro tiene tres propósitos diferentes en el curso de esta reacción. Actúa como un nucleófilo, facilita la abstracción de protones, y es también el grupo saliente en la etapa final. La condensación benzoínica es una dimerización y no una condensación debido a una molécula pequeña como el agua no es liberada en esta reacción, sino el grupo cianuro. Por esta razón, la reacción también se le llama adición benzoínica. En esta reacción, los dos aldehídos tienen dos finalidades: un aldehído dona un protón y el otro acepta un protón. El 4-dimetilaminobenzaldehído es un donador de protones eficiente, mientras benzaldehído es tanto receptor de protones como donador. De esta manera es posible sintetizar benzoinas mixta.
Aplicación
La reacción puede emplearse con aldehídos alifáticos en presencia de medio básico y sales de tiazolio; el mecanismo de reacción es esencialmente el mismo. Estos compuestos son importantes en la síntesis de compuestos heterocíclicos. La adición es también posible con enonas, por ejemplo, la metil vinil cetona (Véase reacción de Stetter).
En bioquímica, la coenzima tiamina es responsable de la biosíntesis de compuestos aciloínicos. Esta coenzima también contiene un resto de tiazolio, que al sufrir desprotonación se convierte en un carbeno nucleofílico.
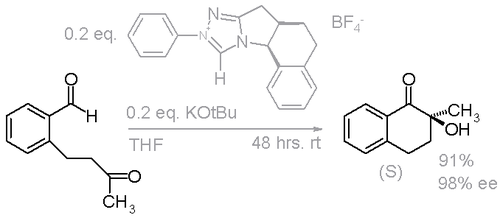
En un estudio, un carbeno N-heterocíclico (NHC) se seleccionó para facilitar una condensación benzoínica intramolecular y enantioselectiva (esquema 2).[6]
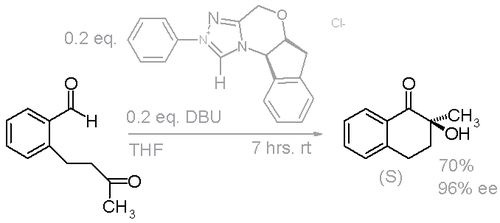
Este hallazgo fue confirmado en otro estudio empleando un NHC ligeramente modificado y DBU como la base en vez de ter-butóxido de potasio (Esquema 3)[7]
Referencias
- ↑ Roger Adams and C. S. Marvel (1941). "Benzoin". Org. Synth.; Coll. Vol. 1: 94.
- ↑ Wöhler, Liebig (1832). «Untersuchungen über das Radikal der Benzoesäure». Annalen der Pharmacie 3 (3): pp. 249–282. doi:.
- ↑ N. Zinin (1839). «Beiträge zur Kenntniss einiger Verbindungen aus der Benzoylreihe». Annalen der Pharmacie 31 (3): pp. 329–332. doi:.
- ↑ N. Zinin (1840). «Ueber einige Zersetzungsprodukte des Bittermandelöls». Annalen der Pharmacie 34 (2): pp. 186–192. doi:.
- ↑ CXXII. — Reactions involving the addition of hydrogen cyanide to carbon compounds. Part II. Cyanohydrins regarded as complex acids Arthur Lapworth, Journal of the Chemical Society, Transactions, 1904, 85, 1206 - 1214. doi 10.1039/CT9048501206
- ↑ D. Enders, O. Niemeier and T. Balensiefer (2006). «Asymmetric Intramolecular Crossed-Benzoin Reactions by N-Heterocyclic Carbene Catalysis». Angewandte Chemie International Edition 45 (9): pp. 1463–1467. doi:. PMID 16389609.
- ↑ H. Takikawa, Y. Hachisu, J. W. Bode and K. Suzuki (2006). «Catalytic Enantioselective Crossed Aldehyde-Ketone Benzoin Cyclization». Angewandte Chemie International Edition 45 (21): pp. 3492–3494. doi:. PMID 16637094.
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.