- Equilibrio ácido-base
-
Equilibrio ácido-base
En química, se llama equilibrio ácido-base al la forma quimica que se da en una reacción de neutralización. Es decir, en la reacción de ácidos y bases, para formar sales y nitrogenos. Una reacción de neutralización sencilla se da de la siguiente forma:
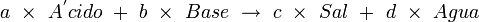
En ese caso, está representada por la siguiente ecuación de equilibrio:
![K=\frac{[Sal]^c \times [Agua]^d}{[A^'cido]^a \times [Base]^b}](/pictures/eswiki/101/eeecba332fac09db5916e2eae73a45af.png)
Concentración
Algunos ejemplos de soluciones son las soluciones de bases o ácidos para reacciones de titulación, los reactivos inorgánicos para reacciones orgánicas y las soluciones fisiológicas. Para preparar soluciones exactas o reproducibles, es necesario indicar la cantidad de soluto con respecto a la cantidad de solvente o de solución, a dicha relación se le da el nombre de concentración.
Formas de expresar la concentración
Comúnmente se dice que una solución esta diluida, cuando tiene poco soluto con respecto al solvente; concentrada, cuando una cantidad considerable de soluto se ha disuelto y saturada cuando el solvente ya no tiene capacidad de disolver o se ha disuelto todo el soluto posible. Estas son formas comunes (prácticas y caseras) de relacionar al soluto y al solvente, pero obviamente son inexactas, por ello se crearon otras formas (exactas) de expresar la concentración, por ejemplo:
A) Porciento ( % p/v , % v/v) B) Partes por millón (ppm) C) Formalidad D) Molaridad E) Normalidad
Todas estas formas que expresan la cantidad de soluto con respecto a la cantidad de solvente (la concentración) y su única diferencia es que en unas se dice la cantidad en masa (peso) del soluto y en otras se involucra el PM del soluto. Estas formas son interconvertibles es decir se puede expresar su concentración en % y convertir a su concentración Normal equivalente. Es importante conocer con exactitud la concentración de una solución, porque la mayoría de las operaciones químicas son cuantitativas (se requiere conocer cuánto) e igualmente importante es entender como se realizan los cálculos y como se preparan en el laboratorio. Las formas anteriormente mencionadas no son todas, existen por ejemplo la molalidad y la fracción mol (que son menos frecuentes), pero no menos importantes .
A) Porciento (% p/v , % v/v) La nomenclatura p/v y v/v , significa si la solución es peso-volumen o volumen-volumen (sólido disuelto en líquido o líquido disuelto en líquido), generalmente son p/v , por ejemplo una solución de NaOH. El porcentaje (%) es una fracción relativa de algún valor multiplicada por 100, para entender esto se usara un ejemplo simple: "Supongamos que se tienen 20 listones; 8 listones verdes, 9 azules y 3 rojos; para referirnos a los listones rojos diríamos que hay 3 de 20 y expresado en fracción sería (3/20), pero si esa fracción se multiplica por 100, sería (3/20 X 100) , lo que equivale a decir que el 15 % de los listones son rojos" . En una solución el total es soluto más solvente. Es decir g de soluto + ml de solvente = ml de solución , y si se desea saber cuanto soluto hay con respecto a la solución, la fracción sería g de soluto/ml de solución , y si esa fracción se multiplica por 100, sería el porciento.
% p/v = g soluto X 100ml de soluciónPor ejemplo si se agregan 10g de soluto, para preparar 500 ml de solución se diría 10g en 500 ml, pero expresado en porciento sería.
% p/v = 10 g de soluto X 100500 ml de solución% p/v = 2% , se dice que es una "solución al 2 %".
Ejemplo: ¿Cuál es la concentración en % cuando se añaden 130g de NaOH y se completa con agua (o se afora) hasta alcanzar un volumen de solución de 1 litro?.
% p/v = 130 g de NaOH X 100
1000 ml de solución% p/v = 13 % , se dice que es una "solución de NaOH al 13 %".
La fórmula tiene 3 incógnitas (3 variables) por lo que se puede cuestionar cualquiera de ellas, si se dan las 2 restantes. Ejemplo: ¿Cuántos g de Na2CO3 se necesitan para preparar 250 ml de una solución al 5%?. Despejando de la fórmula:
g de soluto = (ml de solución) X (% p/v) 100 g de Na2CO3 = (250 ml) X (5%) 100 g de Na2CO3 = 12.5 gCuando el soluto es líquido entonces la fórmula es:
% v/v = ml de soluto X 100ml de soluciónPor ejemplo, se disolvieron 10 ml de alcohol y se aforó con agua para completar 100 ml de solución. ¿ Cuál es su concentración en % ?
%v/v = 10 ml de soluto X 100
100 ml de solución% v/v = 10% , se dice que es una "solución de alcohol al 10 %"
B) Partes por millón (ppm) Partes por millón significa que hay una millonésima parte del soluto con respecto a la solución (si se toma como equivalente g = ml) , es decir 1 mg de soluto por un litro (mg/l) o un gramo por 1000 litros de solución (g/m3) , etc. La concentración ppm se utiliza para relacionar el soluto con respecto a la solución, y al igual que en % , no se requiere del PM de la substancia.
ppm = mg de solutolitros de soluciónEjercicio ¿ Cuál es la concentración en ppm de Mn disuelto en agua de pozo (de Navojoa) no tratada, si se tienen 0.018 g de Mn, disueltos en 500 ml de solución?
ppm = 1.8 mg de soluto
0.5 litros de soluciónppm = 0.9 , se dice que es una "solución al 0.9 ppm de manganeso".
C) Formalidad La concentración Formal o Formalidad, es el número de PF (pesos fórmula , que es equivalemte al peso molecular) por litros de solución. , por lo tanto si una solución contiene un peso fórmula gramo de HCl (36.5 g), en un litro de solución, su concentración es 1 Formal.
F = # de PF de solutolitros de solución- PF = g de soluto
PFPOR LO TANTO
F = g de soluto/ PF
litros de soluciónPor ejemplo el PF del AgNO3 es de 169.88g y disolvemos 3.3978g de AgNO3 en un litro, la concentración será :
F = 3.3978 g/ 169.88
1 litro F = 0.02 , se dice que es una "solución al 0.02 Formal ".D) Molaridad La concentración Molar o Molaridad, es el número de moles por litros de solución. , por lo tanto si una solución contiene un mol de NaCl (58.5 g), en un litro de solución, su concentración es 1 Molar.
M = # moles de solutolitros de solución- moles = g de soluto
PMPOR LO TANTO
M = g de soluto/ PM
litros de soluciónEjercicio: Cuál es la concentración molar de una solución que se preparó con 12.5 g de NaCl y se aforó hasta acompletar 2 litros de solución. PM de NaCl 0 58.5.
M = 12.5 g/ 58.5
2 litros M = 0.106 , se dice que es una "solución 0.106 Molar ".Por ejemplo, ¿ Cuál será la molaridad de una solución que se prepara disolviendo 15 g de CH3COONa y se afora a 250 ml ?. PM del = 82
M = 15 g/ 82
0.25 litros M = 0.73 , se dice que es una "solución 0.73 Molar ".Nota : El mol (peso molecular gramo) es la suma de los pesos atómicos de los átomos que constituyen una molécula, esto significa que la condición necesaria para determinar la molaridad de una substancia, es que exista realmente como molécula en solución. Por ejemplo si disolvemos 36.5 g de HCl , que es un peso fórmula (PF), en un litro de solución, tendremos una concentración 1 Formal. Pero una vez que el gas se disuelve en agua se disocia completamente en iones hidrógeno y en iones cloruro, por lo que no existen moléculas de HCl en disolución, por lo tanto "no podemos" determinar la Molaridad del ácido clorhídrico en la solución. Muchos autores consideran como sinónimos a la formalidad y la molaridad (numéricamente), independientemente de que las substancias existan o no como moléculas en solución.
E) Normalidad La concentración Normal o Normalidad, es el número de pesos equivalentes por litros de solución. , por lo tanto si una solución contiene un peso equivalente de CaCO3 (100 g), en un litro de solución, su concentración es 1 Normal.
N = # equivalentes de solutolitros de solución- equivalentes = g de soluto
PeqPeq = PM
ndonde n es igual al número de iones hidrógenos (H+) de un ácido, o de iones hidroxilo (OH-1) de una base, o la carga del catión en una sal (por ejemplo Ca +2) en el CaSO4, o el número de electrones transferidos en una reacción redox. POR LO TANTO
N = g de soluto / (PM/n)
litros de soluciónEjercicio: Cuál es la concentración Normal de una solución que se preparó con 12.5 g de HCl y se aforó hasta completar 2 litros de solución. PM del HCl = 36.5 .
N = 12.5 g / (36.5/1)
2 litros N = 0.17 , se dice que es una "solución 0.17 Normal ".EJERCICIOS
1) H2SO4 2 H+ + SO4-2 ( el ácido se disocia en 2 H+)
- ¿Cuál es la Normalidad de una solución que se preparó con 5 g de H2SO4 y se aforó a 500 ml de solución ? . Donde n = 2 (es el número de H+)
N = 5 g / (98/2)0.5 litros N = 0.204 , se dice que es una "solución 0.204 Normal ".- Calcular la Normalidad de una solución de NaOH que se preparo añadiendo 30 g y aforando a 100 ml es la siguiente :
2) NaOH Na + OH ( Se disocia o contiene un sólo OH, por lo que n=1)
- Calcular la Normalidad de una solución de NaOH que se preparo añadiendo 30 g y aforando a 100 ml es la siguiente (PM NaOH= 40) :
N = 30 g / (40/1)
0.1 litros N = 7.5 , se dice que es una "solución 7.5 Normal ".3) Reacción Ba+2 + 2 Cl-1 BaCl2 (se requieren 2 PF del Cl-1 o la carga del Ba es 2 ; n=2)
- ¿Cuál es la concentración Normal de una solución de 2 litros que se preparó, disolviendo 340g de BaCl2 ? . PM BaCl2 = 208.5
N = 340 g / (208.5/2)
2 litros N = 1.630 , se dice que es una "solución 1.630 Normal ".3) Reacción
5 Fe+2 + MnO4- + 8 H+ 5 Fe+3 + Mn+2 + 4 H2O
¿Cuál es la concentración Normal de una solución que se preparó disolviendo 15g de KMnO4 en 250 ml de solución (esta solución se usará en una reacción redox) ? Mn+7 Mn+2 (+5e-) , es decir el número de electrones transferidos es de 5, n=5.
N = 15 g / (158/5)
0.25 litros N = 1.898 , se dice que es una "solución 1.898 Normal ".PROBLEMAS (resuelve los siguientes problemas): 1. El vinagre casero se prepara agregando ácido acético al agua al 5%, ¿cuántos ml de ácido acético se necesitan para preparar 250 ml de solución? R. 2. ¿Cuántos g de CuSO4 se necesitan para preparar 250 ml de solución al 12.5%? R. 3. ¿Cuál es la concentración de la solución para batería, si se prepara agregando 24 ml de H2SO4 y aforando a 250 ml ?. R. 4. ¿Cuántos mg de CaCO3 se encuentran disueltos en una muestra de agua de la llave ( de Guaymas), sí se tiene n 3500 ml de solución de 200 ppm de CaCO3 ? R. 5. ¿ Qué volumen tiene una solución de KBr si se tiene una solución 3 F, donde se disolvieron 20 g de la sal ? R. 6. ¿Cuál es la Formalidad de una solución que se preparó con 160g de hidróxido de amonio y se aforó a 3 litros ? R. 7. ¿Cuál es la molaridad de un litro solución de NaCl, donde se disolvieron 130 g ? R. 8. ¿Cuántos g se necesitan para preparar 250 ml de una solución de KOH 6 Molar ? R. 9. ¿ Diga cuál es la Normalidad de una solución que se preparó con 20 ml de H3PO4 concentrado y se aforó a 1 litro? 1ml del ácido concentrado = g . R. 10. ¿Cuántos g de AgCl se necesitan para preparar 100 ml de una solución 2 N ? R. 11. ¿Cuál es la Normalidad de una solución de PbSO4 que se requieren para preparar 250 ml de solución 1 N, sí esta solución se empleará en una reacción redox ; Pb+4 Pb+2 ? R. 12. ¿ Como prepararías 50 ml de solución de CuSO4 al 34% ? 13. ¿ Cuántos g de HClO4 se necesitan para preparar 500 ml de una solución 2 M? 14. A que concentración Molar y Normal equivale una solución de H3PO4 al 5 %. 15. ¿ Cómo prepararías 250 ml de Fe2(CO3)3 0.5 M ? 16. Cuál es la concentración Normal de 50 ml de solución de HCL, si al titularlo se gastan 26 ml de NaOH 0.3 N ?. 17. ¿Cómo prepararías 1litro de H2SO4 2.5 N ? 18. ¿ Cómo prepararías una solución de H2SO4 al 2% ? 19. ¿ Que porcentaje de NaOH, tiene un limpiador, si se titularon 50 ml del limpiador con 42ml de HCl 3N? 20. ¿ Qué porcentaje de ácido cítrico tiene el limón si titulas 25 ml de una solución que preparaste con 5 ml de jugo de limón y aforando con agua a 100 ml ?. 21.¿ Cuál es la concentración del HCl, H2SO4, HNO3,H3PO4 y del NH4OH en la forma más concentrada en los reactivos del LAB ?
Constante de disociación La Constante de disociación o Kd es definida en termodinámica química como la relación matemática que se establece a partir de las concentraciones de los compuestos químicos que se forman en una reacción de disociación al alcanzar su punto de equilibrio. Si un compuesto de formula Ax By se disocia según la reacciónla constante de disociación Kd se expresa mediante la siguiente relación de concentraciones (en moles por litro):
A menudo, la constante de disociación también se formula por pKd siendo pKd = -log(Kd). Ejemplo: constante de disociación del agua [editar] La constante de disociación del agua, expresada por Ke (Kw en inglés), es la constante de reacción asociada a la reacción química de autoprotolisis: 2H2O = OH- + H3O+ Los productos de ésta reacción son los iones oxonio (o iones hidronio) y los hidroxilos. En el estado de equilibrio químico, y en el caso de disoluciones diluidas, el Ke corresponde al producto de las concentraciones en iones, que en el caso de condiciones normales de temperatura y presión, cumplen la relación:
Ke = [H3O+]×[OH-] = 10-14 y pKe = -log(Ke) = 14 Esta reacción del agua ocurre de manera natural y espontánea, de manera que en el agua a presión atmosférica se encuentran tanto moléculas de agua como iones en una relación de concentraciones acorde con la Ke específica a cada temperatura: Temperatura del H2O Kd*10-14 pKd 0°C 0.1 14.92 10°C 0.3 14.52 18°C 0.7 14.16 25°C 1.2 13.92 30°C 1.8 13.75 50°C 8.0 13.10 60°C 12.6 12.90 70°C 21.2 12.67 80°C 35 12.46 90°C 53 12.28 100°C 73 12.14 Obtenido de "http://es.wikipedia.org/wiki/Constante_de_disociaci%C3%B3n"
pOH El pOH se define como el logaritmo negativo de la actividad de los iones de hidróxido. Esto es, la concentración de iones OH-: pOH = − log10.[OH − ] En soluciones acuosas, los iones OH- provienen de la disociación del agua: H2O ↔ H+ + OH- o también, 2H2O ↔ H3O+ + OH-
Por ejemplo, una concentración de [OH-] = 1×10-7 M (0,0000001 M) es simplemente un pOH de 7 ya que : pOH = -log[10-7] = 7 Al igual que el pH, típicamente tiene un valor entre 0 y 14 en disolución acuosa, siendo ácidas las disoluciones con pOH mayores a 7, y básicas las que tienen pOH menores a 7. Por lo tanto, pH + pOH = 14
pKa pKa es parecido al pH, es la fuerza que tienen las moléculas de disociarse (es el logaritmo negativo de la constante de disociación de un ácido débil).
Una forma conveniente de expresar la relativa fortaleza de un ácido es mediante el valor de su pKa, que permite ver de una manera sencilla en cambios pequeños de pKa los cambios asociados a variaciones grandes de Ka. Valores pequeños de pKa equivalen a valores grandes de Ka (constante de disociación) y, a medida que el pKa decrece, la fortaleza del ácido aumenta. Constantes de disociación en algunos ácidos: • Acético 4,7 • Aluminio (hidróxido) 12,4 • Aluminio (ión) 4,9 • Amonio (ión) 9,3 Un ácido será más fuerte cuanto menor es su PKa y en una base pasa al reves, que es más fuerte cuanto mayor es su PKa. Esas constantes de disociación no son fijas, dependen de otras variables
Véase también
- Ácido-base
Categorías: Equilibrio químico | Reacciones químicas
Wikimedia foundation. 2010.
