- Ácido láctico
-
Ácido láctico
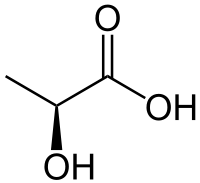
Nombre (IUPAC) sistemático Ácido 2-hidroxipropanoico General Fórmula semidesarrollada H3C-CH(OH)-COOH Fórmula molecular C3H6O3 Identificadores Número CAS [50-21-5]
L:[79-33-4]
D:[10326-41-7]
D/L:[598-82-3]Propiedades físicas Densidad 1.206 kg/m3; 1.206 g/cm3 Masa molar 90.08 g/mol Punto de ebullición 371 K (198 °C) Propiedades químicas Acidez (pKa) 3.5 Compuestos relacionados Ácidos relacionados Ácido propanoico, Ácido pirúvico Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl ácido láctico, o su forma ionizada, el lactato (del lat. lac, lactis, leche), también conocido por su nomenclatura oficial ácido 2-hidroxi-propanoico o ácido α-hidroxi-propanoico, es un compuesto químico que desempeña importantes roles en diversos procesos bioquímicos, como la fermentación láctica. Es un ácido carboxílico, con un grupo hidroxilo en el carbono adyacente al grupo carboxilo, lo que lo convierte en un ácido α-hidroxílico (AHA) de fórmula H3C-CH(OH)-COOH (C3H6O3). En solución puede perder el hidrógeno unido al grupo carboxilo y convertirse en el anión lactato.
El ácido láctico es quiral, por lo que se pueden encontrar dos enantiómeros (isómeros ópticos). Uno es el dextrógiro ácido D-(-)-láctico o d-ácido láctico (en este caso, el ácido (R)-láctico]]; el otro es el levógiro ácido L-(+)-láctico o ℓ-ácido láctico (en este caso, ácido (S)-láctico), que es el que tiene importancia biológica. La mezcla racémica (cantidades idénticas de estos isómeros) se llama d,ℓ-ácido láctico.
Contenido
Importancia biológica
El ácido ℓ-láctico se produce a partir del ácido pirúvico a través de la enzima lactato deshidrogenasa (LDH) en procesos de fermentación. El lactato se produce constantemente durante el metabolismo y sobre todo durante el ejercicio, pero no aumenta su concentración hasta que el índice de producción no supere al índice de eliminación de lactato. El índice de eliminación depende de varios factores, como por ejemplo: transportadores monocarboxilatos, concentración de LDH y capacidad oxidativa en los tejidos. La concentración de lactatos en la sangre usualmente es de 1 o 2 mmol/l en reposo, pero puede aumentar hasta 20 mmol/l durante un esfuerzo intenso. Se debe considerar, que a PH fisiológico en el cuerpo humano, es decir 7.35, se encuentra sólo en su forma disociada, es decir, como lactato y no como ácido.
El aumento de la concentración de lactatos ocurre generalmente cuando la demanda de energía en tejidos (principalmente musculares) sobrepasa la disponibilidad de oxígeno en sangre. Bajo estas condiciones la piruvato deshidrogenasa no alcanza a convertir el piruvato a Acetil-CoA lo suficientemente rápido y el piruvato comienza a acumularse. Esto generalmente inhibiría la glucólisis y reduciría la producción de Adenosín trifosfato (ATP, sirve para acumular energía), si no fuera por que la lactato deshidrogenasa reduce el piruvato a lactato:
piruvato + NADH + H+ --> lactato + NAD+
La función de la producción de lactato es oxidar NADH + H para regenerar la nicotinamida adenina dinucleótido (NAD+) necesario para la glucólisis y entonces para que continúe la producción de ATP.
El lactato producido sale de la célula muscular y circula mediante el torrente sanguíneo hasta el hígado, dónde se vuelve a transformar en glucosa por gluconeogénesis. Al ciclo que comprende la glicólisis en la célula muscular y su reciclaje por gluconeogénesis en el hígado se conoce como ciclo de Cori.
El hígado y el corazón tienen la facultad de oxidar el lactato de la sangre convirtiéndolo de nuevo a piruvato.
La fermentación de ácido láctico también la produce las bacterias Lactobacillus. Estas bacterias pueden encontrarse en la boca, y puede ser las responsables del progreso de la caries previamente iniciada por otras bacterias .
En medicina
En medicina es uno de los compuestos de solución láctica de Ringer, que es una solución que se inyecta introvenosamente a las personas cuando han sufrido una pérdida de sangre a causa de un trauma, cirugía o quemadura. El lactato está compuesto por 129 mmo/lt de Na, 109 mmol/lt de cloro y 28 mmol/lt de lactato. Es una solución que se usa con la salina fisiológica (0.9%) para recuperar volumen. La diferecia de iones fuertes hace que el hartman (Lactato ringer) sea utilizado por algunos como terapìa en hipovolemia. No obstante por tener menos tonicidad (osmolaridad menor que la salina) algunos prefieren la salina. El efecto sobre el equilibrio ácido base de la salina será promover acidosis (por el cloro), mientras el efecto del hartman será más alcalinizante por la diferencia de iones fuertes y por el lactato.
Ejercicio y lactato
Durante el ejercicio intenso, cuando hay demasiada demanda de energía, el lactato se produce más rápidamente que la capacidad de los tejidos para eliminarlo y la concentración de lactato comienza a aumentar. Es un proceso benéfico, porque la regeneración de NAD+ asegura que la producción de energía continúe y así también el ejercicio.
Al contrario de lo que mucha gente cree, el incremento de la cantidad de lactato no es causante directo de la acidosis ni es responsable de las agujetas. Esto se debe a que el ácido láctico no es capaz de liberar el catión hidrógeno y en segundo lugar porque la acidez del lactato (ácido láctico) no se encuentra en estado ácido, sino en su forma base, como lactato. Análisis de la ruta glucolítica indica que no hay suficientes cationes hidrógenos presentes como para formar ácido láctico o cualquier otro tipo de ácido. Para destacar, a PH fisiológico a nivel de la célula muscular (miocito), y de acuerdo al PKa ácido del ácido láctico (pka:3.86), lo que se va a encontrar es la base: el lactato, y no el ácido láctico, debido a que estará totalmente disociado en estas condiciones.
La acidosis que muchas veces se asocia a la producción de lactato durante ejercicios extremos proviene de una reacción completamente distinta y separada. Cuando se hidroliza (se "separa" en agua) el ATP se libera un catión hidrógeno. Este catión es el principal responsable de la disminución del pH. Durante ejercicios intensos el metabolismo oxidativo (aerobiosis) no produce ATP tan rápido como lo demanda el músculo. Como resultado la glucólisis se transforma en el principal productor de energía y puede producir ATP a altas velocidades. Debido a la gran cantidad de ATP producido e hidrolizado en tan poco tiempo, los sistemas buffer de los tejidos se ven agotados, causando una caída del pH y produciendo acidosis. Éste es uno de los factores, entre tantos, que contribuye al dolor muscular agudo experimentado poco después del ejercicio intenso.
Obtención
Fermentación láctica
- A partir del azúcar de la leche (lactosa) con el Bacillus lactis acid
- A partir de almidón, azúcar de uva (glucosa) o azúcar de caña (sacarosa) utilizando el Bacillus Delbrücki
La obtención de ácido láctico con enzimas o microorganismos vivos pueden producir isómeros dextrógiros o levógiros, dependiendo de la enzima involucrada en el proceso.
Síntesis en laboratorio
Puede obtenerse una mezcla racémica a partir de etanol y cianuro de sodio:
2 CH3 - CHOH + 2 NaCN + 2 H2SO4 + 4 H2O ==> 2 CH3-CH(OH)-COOH + Na2SO4 + (NH4)2SO4
2CH3 − CHOH + 2NaCN + 2H2SO4 + 4H2O = = > 2CH3 − CH(OH) − COOH + Na2SO4 + (NH4)2SO4
El proceso termina con un ataque nucleofílico del cianuro al grupo carbonilo del aldehído formando el nitrilo del ácido láctico de forma racémica. El nitrilo es saponificado en presencia de agua y un exceso de ácido sulfúrico para dar el ácido libre.
Ocurrencia
Es encontrado en el jugo de la carne, en la leche ácida, en los músculos y en algunos órganos de algunas plantas o animales. Suele mencionarse como origen de las agujetas, el dolor muscular provocado por el ejercicio repentino sin tener costumbre (ver importancia biológica).
Aplicaciones y usos
Cosmética
Se utiliza como la alternativa más amplia al uso de la glicerina como suavizante. Es usado principalmente como químico anti-edad para suavizar contornos; reducir el daño producido por la luz solar; para mejorar la textura y el tono de la piel, y el aspecto en general.
Sin embargo deben tomarse serias precauciones al utilizar cosméticos con ácido láctico, porque aumentan la sensibilidad a los rayos ultravioleta del sol.
Alimentos
El ácido láctico es utilizado en varios productos como regulador de acidez. Aunque puede obtenerse de la lactosa (azúcar de la leche), la mayor parte del ácido láctico empleado comercialmente deriva del uso de bacterias como la Bacillus acidilacti, Lactobacillus delbrueckii o Lactobacillus bulgaricus para fermentar fuentes de carbohidratos como la maicena y las patatas. Así, lo que comúnmente se denomina "leche ácida" en alimentos vegetarianos o veganos tienen ácido láctico como ingrediente.
Otras aplicaciones
- Alimento para niños.
- Purgante, en la forma de lactato de calcio o lactato de magnesio.
- Aditivo en alimentos o fragancias, en la forma de lactato de etilo.
- Removedor de sales de calcio.
- Como mordiente.
- Curtimiento de pieles.
- Materia prima para síntesis orgánica.
- Acción acaricida: Es utilizado en el control del varroasis, ácaro que ataca la abeja melífera Apis mellifera.
- Materia prima para Biopolimeros.
Curiosidades
- El ácido láctico, uno de los dos primeros ácidos conocidos, fue descubierto por el químico sueco Carl Wilhelm Scheele, con leche en polvo.
- En la fibra muscular, en condiciones de ejercicio intenso, se produce lactato y no ácido láctico, debido al PKa de éste y al PH celular.
- Es el responsable del "rigor mortis" en los cadáveres, al intentar sobrevivir las células musculares en ausencia de oxígeno.
Enlaces externos
Categorías:- Ácidos carboxílicos
- Código ATC G
- Lactatos
Wikimedia foundation. 2010.
