- Peso molecular medio por partícula
-
Peso molecular medio por partícula
El peso molecular medio por partícula resulta del inverso la suma de los inversos del peso molecular por ion con el peso molecular por electrón. En el caso del peso medio por ion simboliza el peso medio de un ion de la mezcla mientras que en el peso medio por electrón es el peso molecular por cada electrón de la mezcla. Se calculan de la siguiente manera:
Sea una especie química j. Se tratará de hallar, en primer lugar, el número de partículas de cada especie por unidad de volumen.
Para hallar el número de iones por unidad de volumen de cada especie se multiplicará la densidad por la fracción de masa para obtener solo la densidad de esa sustancia concreta. Luego se dividirá por el número másico dado en (uma o g/mol). Solo bastará multiplicar por el número de Avogadro para obtener el número de iones. Para el caso de los electrones hará falta un paso más ya que todos los iones salvo los de hidrógeno poseen más de un electrón en su corteza. Concretamente habrá que multiplicar el resultado por el número atómico que no es otra cosa que el número de protones del ion. Ese valor dicta el número de electrones que se pueden desprender de él como máximo. Dichos valores se obtienen como sigue:
Número de iones:
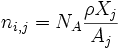
Número de electrones:
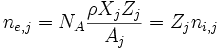
Donde NA es el número de Avogadro, ρ la densidad de la estrella, Xj la fracción de masa, Zj el número atómico y Aj el número másico.De estas expresiones puedo sacar el peso molecular medio por ion, por electrón y por partícula.
Peso molecular medio por ion:
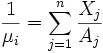
Peso molecular medio por electrón:
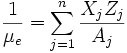
Peso molecular medio por partícula:
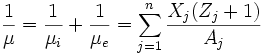
Sabiendo que para elementos más hallá del helio una buena aproximación es:
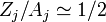
Se puede afirmar entonces que: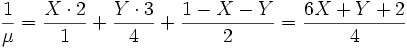
Donde X es la fracción de masa del hidrógeno, Y la del helio y (1-X-Y) la de los metales. Ver metalicidad.Dado que cuanto más pesados son los elementos el número másico tiende a ser el doble que el número atómico en los núcleos de estrellas en fases avanzadas el peso molecular medio por electrón valdrá siempre 2.
Esto ocurre, por ejemplo, en las enanas blancas de carbono y oxígeno donde:
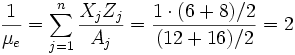
Como se ve se ha hecho una aproximación considerando un 50% de cada elemento algo no muy alejado de la realidad aunque de hecho se desconoce su proporción real en las enanas blancas.
Véase también
Categoría: Propiedades químicas
Wikimedia foundation. 2010.
