- Ion
-
 Solución de sal común en agua. El cloruro de sodio de la sal se disocia en dos iones: el catión sodio y el anión cloruro.
Solución de sal común en agua. El cloruro de sodio de la sal se disocia en dos iones: el catión sodio y el anión cloruro.
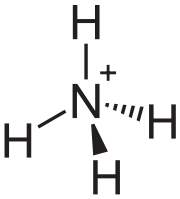 Ion amonio.
Ion amonio.
Un 'ion[1] (‘el que va’, en griego; siendo ἰών [ion] el participio presente del verbo ienai: ‘ir’) es una partícula cargada eléctricamente constituida por un átomo o molécula que no es eléctricamente neutra. Conceptualmente esto se puede entender como que, a partir de un estado neutro de un átomo o partícula, se han ganado o perdido electrones; este fenómeno se conoce como ionización.
Lo iones cargados negativamente, producidos por haber más electrones que protones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
'Anión' y 'catión' significan:
- Anión: "el que va hacia abajo". Tiene carga eléctrica negativa.
- Catión: "el que va hacia arriba". Tiene carga eléctrica positiva.
'Ánodo' y 'cátodo' utilizan el sufijo '-odo', del griego odos (-οδος), que significa camino o vía.
- Ánodo: "camino ascendente".
- Cátodo: "camino descendente".
Un ion conformado por un solo átomo se denomina ion monoatómico, a diferencia de uno conformado por dos o más átomos, que se denomina ion poliatómico.
Contenido
Energía de ionización
La energía de ionización, también llamada potencial de ionización, es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental, para arrancarle el electrón más débil retenido.
Podemos expresarlo así:X+ + 2ªE.I. X2+ + e-
Puedes deducir tú mismo el significado de la tercera energía de ionización y de las posteriores.
La energía de ionización se expresa en electrón-voltio, julios o en Kilojulios por mol (kJ/mol).
1 eV = 1,6.10-19 culombios . 1 voltio = 1,6.10-19 julios
En los elementos de una misma familia o grupo la energía de ionización disminuye a medida que aumenta el número atómico, es decir, de arriba abajo.
En los alcalinos, por ejemplo, el elemento de mayor potencial de ionización es el litio y el de menor el francio. Esto es fácil de explicar, ya que al descender en el grupo el último electrón se sitúa en orbitales cada vez más alejados del núcleo y, además, los electrones de las capas interiores ejercen un efecto de apantallamiento frente a la atracción nuclear sobre los electrones periféricos por lo que resulta más fácil extraerlos.
En los elementos de un mismo período, la energía de ionización crece a medida que aumenta el número atómico, es decir, de izquierda a derecha.
Esto se debe a que el electrón diferenciador está situado en el mismo nivel energético, mientras que la carga del núcleo aumenta, por lo que será mayor la fuerza de atracción y, por otro lado, el número de capas interiores no varía y el efecto de apantallamiento no aumenta.
Sin embargo, el aumento no es continuo, pues en el caso del berilio y el nitrógeno se obtienen valores más altos que lo que podía esperarse por comparación con los otros elementos del mismo período. Este aumento se debe a la estabilidad que presentan las configuraciones s2 y s2p3, respectivamente.
La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar un electrón. Puedes deducir y razonar cuáles son los elementos que presentan los valores más elevados para la segunda y tercera energías de ionización.
Clases de iones
Aniones
En los iones negativos, aniones, cada electrón, del átomo originalmente neutro, está fuertemente retenido por la carga positiva del núcleo. Al contrario que los otros electrones del átomo, en los iones negativos, el electrón adicional no está vinculado al núcleo por fuerzas de Coulomb, lo está por la polarización del átomo neutro. Debido al corto rango de esta interacción, los iones negativos no presentan series de Rydberg, Un átomo de Rydberg es un átomo con uno o más electrones que tienen un número cuántico principal muy elevado.
Cationes
Los cationes son iones positivos. Son especialmente frecuentes e importantes los que forman la mayor parte de los metales. Son átomos que han perdido electrones, como el oro.
Otros iones
- Un dianión es una especie que tiene dos cargas negativas sobre ella. Por ejemplo: el dianión del pentaleno es aromático.
- Un zwitterión es un ion con una carga neta igual a cero pero que presenta dos cargas aisladas sobre la misma especie, una positiva y otra negativa por lo tanto es negativo
- Los radicales iónicos son iones que contienen un número irregular de electrones y presentan una fuerte inestabilidad y reactividad.
Plasma
Se denomina plasma a un fluido gaseoso de iones. Incluso, se puede hablar de plasma en muestras de gas corriente que contengan una proporción apreciable de partículas cargadas. Se puede considerar a un plasma como un nuevo estado de la materia, (aparte de los estados sólido, líquido y gaseoso), concretamente el cuarto estado de la materia, puesto que sus propiedades son muy distintas a los estados usuales. Los plasmas de los cuerpos estelares contienen, de manera predominante, una mezcla de electrones y protones, estimándose que su proporción es del 99,9% del universo visible.[2]
Algunas aplicaciones de los iones
Los iones son esenciales para la vida. Los iones sodio, potasio, calcio y otros, juegan un papel importante en la biología celular de los organismos vivos, en particular en las membranas celulares. Hay multitud de aplicaciones basadas en el uso de iones y cada día se descubren más, desde detectores de humo hasta motores iónicos. Los Iones de Plata Ag+ han sido utilizados también como germicidas para el tratamiento de diversas enfermedades infecciosas.
Los iones inorgánicos disueltos son un componente de los sólidos (sólidos totales disueltos) presentes en el agua e indican la calidad de esta.
Véase también: Potencial electroquímicoIones frecuentes
Cationes frecuentes Nombre común Fórmula Nombre tradicional Cationes simples Aluminio Al3+ Aluminio Bario Ba2+ Bario Berilio Be2+ Berilio Cesio Cs+ Cesio Calcio Ca2+ Calcio Cromo (II) Cr2+ Cromoso Cromo (III) Cr3+ Crómico Cromo (VI) Cr6+ Percrómico Cobalto (II) Co2+ Cobaltoso Cobalto (III) Co3+ Cobáltico Cobre (I) Cu+ Cuproso Cobre (II) Cu2+ Cúprico Galio Ga3+ Galio Helio He2+ (partícula α) Hidrógeno H+ (Protón) Hierro (II) Fe2+ Ferroso Hierro (III) Fe3+ Férrico Plomo (II) Pb2+ Plumboso Plomo (IV) Pb4+ Plúmbico Litio Li+ Litio Magnesio Mg2+ Magnesio Manganeso (II) Mn2+ Hipomanganoso Manganeso (III) Mn3+ Manganoso Manganeso (IV) Mn4+ Mangánico Manganeso (VII) Mn7+ Permangánico Mercurio (II) Hg2+ Mercúrico Níquel (II) Ni2+ Niqueloso Níquel (III) Ni3+ Niquélico Potasio K+ Potasio Plata Ag+ Argéntico Sodio Na+ Sodio Estroncio Sr2+ Estroncio Estaño (II) Sn2+ Estanoso Estaño (IV) Sn4+ Estánico Zinc Zn2+ Zinc Cationes poliatómicos Amonio NH4+ Hidronio H3O+ Nitronio NO2+ Mercurio (I) Hg22+ Mercurioso Aniones frecuentes Nombre formal Fórmula Nombre alternativo Aniones simples Arseniuro As3− Azida N3− Bromuro Br− Carburo C4− Cloruro Cl− Fluoruro F− Fosfuro P3− Hidruro H− Nitruro N3− Óxido O2− Peróxido O22− Sulfuro S2− Yoduro I− Oxoaniones Arseniato AsO43− Arsenito AsO33− Borato BO33− Bromato BrO3− Hipobromito BrO− Carbonato CO32− Hidrógenocarbonato HCO3− Bicarbonato Clorato ClO3− Perclorato ClO4− Clorito ClO2− Hipoclorito ClO− Cromato CrO42− Dicromato Cr2O72− Yodato IO3− Nitrato NO3− Nitrito NO2− Fosfato PO43− Hidrógenofosfato HPO42− Dihidrógenofosfato H2PO4− Permanganato MnO4− Fosfito PO33− Sulfato SO42− Tiosulfato S2O32− Hidrógenosulfato HSO4− Bisulfato Sulfito SO32− Hidrógenosulfito HSO3− Bisulfito Aniones de ácidos orgánicos Acetato C2H3O2− Formiato HCO2− Oxalato C2O42− Hidrógenooxalato HC2O4− Bioxalato Otros aniones Hidrógenosulfuro HS− Bisulfuro Telururo Te2− Amiduro NH2− Cianato OCN− Tiocianato SCN− Cianuro CN− Hidróxido OH− Véase también
- Ionización
- Enlace iónico
- Afinidad electrónica
- Electronegatividad
- Potencial de reducción
- Plasma estelar
- Fusión nuclear
Notas
- ↑ En el sitio de la RAE (Real Academia Española) se explica que —según la región— hay palabras que se pronuncian de manera mono- o bisilábica, y que «en guion y otras palabras en la misma situación, como ion, muon, pion, prion, Ruan, Sion y truhan, se da preferencia a la grafía sin tilde, aunque se permite que aquellos hablantes que pronuncien estas voces en dos sílabas puedan seguir tildándolas».
- ↑ “Plasma, plasma, everywere”, en Space Science n.° 158, 7 de septiembre de 1999.
Categoría:- Iones
Wikimedia foundation. 2010.
