- Discodermolida
-
Discodermolida
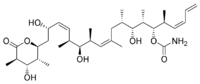 discodermolida
discodermolidaNombre (IUPAC) sistemático (+)-Discodermolida General Fórmula semidesarrollada C33H55NO8 Fórmula molecular n/d Identificadores Número CAS 127943-53-7 Propiedades físicas Densidad n/d Masa molar 593,79 g/mol Punto de fusión 385 K (111,85 °C) Punto de ebullición K (-273,15 °C) Propiedades químicas Solubilidad en agua n/d Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa (+)-discodermolida es un policétido descubierto recientemente, que se ha encontrado que es un potente inhibidor del crecimiento de células tumorales. El esqueleto de carbono de la molécula está hecho por ocho unidades de polipropionato y cuatro de acetato, con 13 estereocentros.
Contenido
Historia
La discodermolida fue aislada por primera vez en 1990 a partir de la esponja marina del Caribe Discodermia dissoluta por el químico Sarath Gunasekera y el biólogo Ross Longley, científicos de la Harbor Branch Oceanographic Institution.[1][2][3] La esponja contenía 0,002% de discodermolida (7 mg/434 g de esponja). Dado que el compuesto es sensible a la luz, la esponja debe ser recolectada a una profundidad mínima de 33 metros. Inicialmente se encontró que la discodermolida tienen actividades inmunosupresoras y antifúngicas.
Mecanismo de acción
La discodermolida ha mostrado inhibir la proliferación de células humanas al detener el ciclo celular en la fase G2 y la fase M. Hiperestabiliza a los microtúbulos, especialmente prevalentes durante la división celular. La hiperestabilización del huso mitótico ocasiona que el ciclo celular se detenga y la muerte celular por apoptosis. En una variedad de líneas celulares, la actividad ha sido medida a IC50 = 3-80 nM.
La discodermolida compite con el paclitaxel por la unión con los microtúbulos, pero con mayor afinidad[4][5][6] y es efectiva también en células de cáncer resistentes al paclitaxel- y la epotilona.[7]
Síntesis total
Se han publicado varias síntesis totales a la fecha por Schreiber[8][9], Smith[10][11][12], Paterson[13], Marshall[14], y Myles[15]. También ha sido publicada una revisión de las varias aproximaciones sintéticas.[16]
Desarrollo clínico
El Harbor Branch Oceanographic Institution licensió la (+)-discodermolida a Novartis, que empezó una fase 1 de ensayo clínico en el 2004. El trabajo con pacientes fue interrumpido debido a la toxicidad de la droga.[17] El grupo de investigación de Amos B. Smith's (en colaboración con Kosan Biosciences) tiene un programa de desarrollo de la droga preclínico en progreso.[18]
El suministro de compuesto enecesario para los ensayos clínicos completos no puede ser alcanzado por recolección, aislamiento y purificación. Hasta el 2005, los intentos de síntesis o semi-síntesis por fermentación no habían tenido éxito. Como resultado, toda la discodermolida usada en estudios preclínicos y ensayos clínicos proviene de síntesis total a gran escala.[19][20]
Véase también
- Dictiostatina
- Epotilona
- Eleuterobina
- Laulimalida
- Paclitaxel
Referencias
- ↑ Gunasekera, S. P.; Gunasekera, M.; Longley, R. E.; Schulte, G. K. J. Org. Chem. 1990, 55, 4912-4915. (DOI 10.1021/jo00303a029)
- ↑ Gunasekera, S. P.; Pomponi, S. A.; Longley, R. E.; Patente USPTO nº 5840750, November 24, 1998.
- ↑ Gunasekera, S. P.; Paul, G. K.; Longley, R. E.; Isbrucker, R. A.; Pomponi, S. A. J. Nat. Prod. 2002, 65, 1643.
- ↑ Ter Haar, E.; Kowalski, R. J.; Hamel, E.; Lin, C. M., Longley, R. E.; Gunasekera, S. P.; Rosenkranz, H. S.; Day, B. W. Biochemistry 1996, 35, 243-250. (Abstract)
- ↑ Hung, D. T.; Chen, J.; Schreiber, S. L. Chem Biol. 1996, 3, 287-293. (Abstract)
- ↑ Klein, L. E.; Freeze, B. S.; Smith, A. B.; Horwitz, S. B. Cell Cycle 2005, 4, 501-507. (Article)
- ↑ Jordan, M. A. Curr. Med. Chem.: Anti-Cancer Agents 2002, 2, 1.
- ↑ Nerenberg, J. B.; Hung, D. T.; Somers, P. K.; Schreiber, S. L. J. Am. Chem. Soc. 1993, 115, 12621-12622. (DOI 10.1021/ja00079a066)
- ↑ Hung, D. T.; Nerenberg, J. B.; Schreiber, S. L. J. Am. Chem. Soc. 1996, 118, 11054-11080. (DOI 10.1021/ja961374o)
- ↑ Smith, A. B. III. et al. J. Am. Chem. Soc. 1995, 117, 12011-12012. (DOI 10.1021/ja00153a030)
- ↑ Smith, A. B.; Beauchamp, T. J.; LaMarche, M. J.; Kaufman, M. D.; Qiu, Y.; Arimoto, H.; Jones, D. R.; Kobayashi, K. J. Am. Chem. Soc. 2000, 122, 8654-8664. (Article)
- ↑ Smith, A. B.; Freeze, B. S.; Xian, M.; Hirose, T. Org. Lett. 2005, 7, 1825-1828.
- ↑ Paterson, I.; Florence, G. J.; Gerlach, K.; Scott, J. P. Angew. Chem. Int. Ed. Engl. 2000, 39, 377. (Article)
- ↑ Marshall, J. A.; Johns, B. A. J. Org. Chem. 1998, 63, 7885-7892. (DOI 10.1021/jo9811423)
- ↑ Harried, S. S.; Yang, G.; Strawn, M. A.; Myles, D. C. J. Org. Chem. 1997, 62, 6098-6099. (DOI 10.1021/jo9708093)
- ↑ Smith, A. B., III; Freeze, B. S. Tetrahedron 2008, 64, 261-298.
- ↑ A phase I pharmacokinetic (PK) trial of XAA296A (Discodermolide) administered every 3 wks to adult patients with advanced solid malignancies. 2004 ASCO Annual Meeting (Abstract and Presentation Slides)
- ↑ Amos B. Smith, III Current Research Projects
- ↑ Mickel, S. J. et al. Org. Process Res. Dev. 2004, 8, 92, 101, 107, 113 and 122.
- ↑ Wulff research group (PDF)
Enlaces externos
- Chemical and Engineering News: Scaled-Up Synthesis of Discodermolide by Michael Freemantle
- Chemistry and Biology of Discodermolide
- The Betzer and Ardisson Synthesis of (+)-Discodermolide
Categoría: Fármacos
Wikimedia foundation. 2010.
