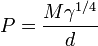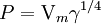- Paracoro
-
Paracoro
El paracoro de un líquido puede ser definido como el volumen ocupado por un mol de esa sustancia en estado líquido, corregido por la fuerza de cohesión entre sus moléculas mediante la tensión superficial. En 1924 S. Sudgen dedujo empíricamente la siguiente ecuación:
donde:
- M = peso molecular del líquido
- γ = tensión superficial del líquido a la temperatura a la que se calcula el paracoro
- d = densidad del líquido a la misma temperatura
Ya que la relación M/d representa el volumen molar del líquido, es decir el volumen ocupado por un mol del líquido, la ecuación anterior puede escribirse como
de donde se vuelve clara la definición dada inicialmente para el paracoro como un "volumen molar corregido".
Estudiando el paracoro de series homólogas de compuestos orgánicos, Sudgen llegó a la importante conclusión de que el paracoro era una propiedad aditiva. Esto significa que el paracoro de una sustancia se puede calcular sumando los valores de los paracoros de cada uno de los átomos que forman la molécula, más las contribuciones correspondientes a las características estructurales de la molécula (enlaces sencillos y múltiples, presencia de anillos). Estos valores del paracoro se obtienen experimentalmente y se pueden encontrar tabulados en la literatura especializada.
Una importante aplicación del paracoro consiste en la posibilidad de asignar una determinada estructura a un compuesto químico y no alguna otra estructura. Un ejemplo es el paraldehído, un trímero del acetaldehído, al que se le asignó una estructura cíclica en base a la concordancia entre el paracoro medido experimentalmente y el paracoro teórico deducido aditivamente, descartando de este modo la otra posibilidad de una estructura de tipo lineal.
Categorías: Fisicoquímica | Mecánica de fluidos
Wikimedia foundation. 2010.