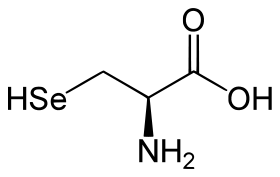
- Selenocisteína
-
Selenocisteína. El aminoácido número 21. Fue descubierto en 1986. Está presente en el ARNm codificado con las bases nitrogenadas UGA, codón conocido por el nombre de ópalo, que generalmente codifica para la terminación de la traducción proteica, pero en conjunción con un fragmento del ARNm denominado SecIS (Secuencia de Inserción de la Selenocisteína) codifica para la inserción de dicho aminoácido en la cadena peptídica. El fragmento SecIS se localiza en arqueobacterias y eucariotas en la sección 3'UTR ,y en bacterias inmediatamente después del codón ópalo.
Los niveles de selenio en el medio celular también son relevantes para la utilización de este aminoácido proteico, esto se debe a que el ARNt que inserta la selenocisteína no contiene dicho aminoácido en un principio, si no que contiene serina, posteriormente, la Selenocisteín-sintetasa cataliza la reacción de este aminoácido inicial con un donador de selenio de alta energia, para formar así el Selenocisteín-ARNt.
Funciones
Los péptidos seleniados forman una familia generalmente enzimática, y presentan la selenocisteina normalmente en su centro activo. En bacterias y arqueobacterias, estas enzimas realizan funciones catabólicas y de oxidación-reducción, mientras que en eucariotas tienen funciones antioxidantes y anabólicas.
Véase también
Enlaces externos
- ATSDR en Español - ToxFAQs™: selenio: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)
- Artículo sobre selenocisteína y pirrolisina en castellano, blog de divulgación científica
- ilustración sobre la inserción de la selenocisteína en castellano
-
El contenido de este artículo incorpora material de una entrada de la Enciclopedia Libre Universal, publicada en español bajo la licencia Creative Commons Compartir-Igual 3.0.
Wikimedia foundation. 2010.