- Villina
-
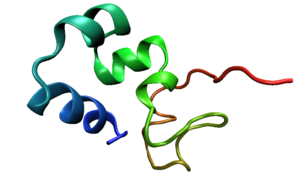
Villina o vilina es una proteína de unión a actina de 92,3 kDa.[1] Como proteína, se trata de una estructura con múltiples dominios tipo gelsolina asociados a una pequeña zona C-terminal (en la imagen) consistente en una horquilla de alfa hélices estabilizadas mediante enlaces hidrofóbicos.[2] Presente en células animales, no obstante existen proteínas semejantes expresadas de forma ubicua en la planta Arabidopsis thaliana.[3]
En su estructura pose lugares de unión para fosfoinosítidos (PIP2).[4] Además, puede sufrir modificaciones postraduccionales como la fosforilación de residuos tirosina.[5] La villina puede dimerizar, empleando para este proceso una zona situada en su extremo amino terminal.[6]
Funciones
Tal como la gelsolina, la villina es un factor que permite que la célula adopte su configuración fluida. Esto lo hace fragmentando los microfilamentos de la corteza celular, en presencia de calcio, haciendo que la célula se vuelva maleable, propiedad necesaria para funciones como la exocitosis.[7] La villina también actúa polimerizando los microfilamentos de actina en las microvellosidades celulares formando haces compactos de actina.[7] Estos haces compactos, a su vez, mantienen la estructura de las microvellosidades.
Referencias
- ↑ Friederich, Evelyne et al. “Villin Function in the Organization of the Actin Cytoskeleton”. Biological Chemistry 274.38 (1999): 26751-26760 PMID 10480879
- ↑ Bazari, Wendy Lavoy, et al. “Villin Sequence and Peptide Map Identify Six Homologous Domains”. Proc. National Academy of ScienceUSA 81 (1988): 4986-4990 PMID 2839826
- ↑ «Villin-Like Actin-Binding Proteins Are Expressed Ubiquitously in Arabidopsis», Plant Physiology 122 (1): 35–48, 2000, http://www.plantphysiol.org/cgi/content/full/122/1/35
- ↑ Meng, Jianmin et al. “High-Resolution Crystal Structures of Villin Headpiece and Mutants with Reduced F-Actin Binding Activity”. Biochemistry 44.36 (2005): 11963 -11973 PMID 16142894
- ↑ Panebra A, Ma SX, Zhai LW, Wang XT, Rhee SG, Khurana S (2001). «Regulation of phospholipase C-gamma(1) by the actin-regulatory protein villin». Am. J. Physiol., Cell Physiol. 281 (3): pp. C1046–58. PMID 11502583.
- ↑ George SP, Wang Y, Mathew S, Srinivasan K, Khurana S (2007). «Dimerization and actin-bundling properties of villin and its role in the assembly of epithelial cell brush borders». J. Biol. Chem. 282 (36): pp. 26528–41. doi:. PMID 17606613.
- ↑ a b Maillet, Marc (2002) (en español). Biología celular. Elsevier, España. pp. 140. ISBN 8445811053. http://books.google.es/books?id=54vSCCv33pYC&source=gbs_navlinks_s.
Wikimedia foundation. 2010.