- Átomo cúbico
-
Átomo cúbico
El átomo cúbico era un modelo atómico temprano, en el que los electrones estaban posicionados en las ocho esquinas de un cubo en un átomo. Esta teoría fue desarrollada en 1902 por Gilbert N. Lewis y fue publicada en 1916 en el artículo "The Atom and the Molecule" (El Átomo y la Molécula) y fue usado para dar cuenta del fenómeno de la valencia. La base de esta teoría fue estructurada en la regla de Abegg. Fue desarrollada posteriormente por Irving Langmuir en 1919, como el átomo del octeto cúbico. La figura a continuación muestra las estructuras de los elementos de la segunda fila de la tabla periódica.
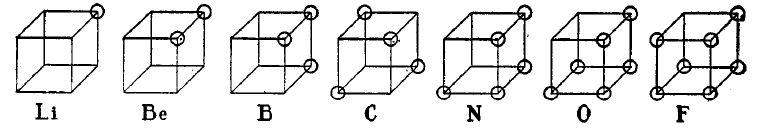
Aunque el modelo del átomo cúbico fue abandonado pronto en favor del modelo mecánico cuántico basado en la ecuación de Schrödinger, y es en consecuencia sólo de interés histórico, representó un paso importante hacia el entendimiento del enlace químico. El artículo de 1916 de Lewis también introdujo el concepto del par de electrones en el enlace covalente, la regla del octeto, y la ahora llamada estructura de Lewis.
Contenido
Enlace en el modelo del átomo cúbico
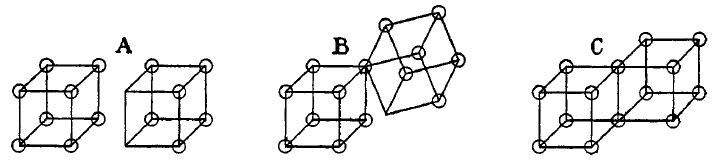
Los enlaces covalentes se forman cuando dos átomos comparten una arista, como en la estructura C que está a continuación. Dicha estructura resulta en la compartición de dos electrones. Los enlaces iónicos se forman por la transferencia de un electrón de un cubo al otro, sin compartir una ariste (A). Lewis también postuló un estado intermedio, B, donde sólo se comparte una esquina.
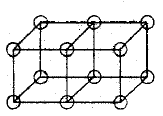
Los enlaces dobles se forman por la compartición de una cara entre dos átomos cúbicos. Esto resulta en la compartición de cuatro electrones:
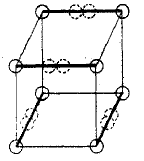
Los enlaces triples no podrían ser interpretados por el modelo del átomo cúbico, porque no hay forma de tener dos cubos compartiendo seis esquinas. Lewis sugirió que los pares de electrones en los enlaces atómicos tienen una atracción especial, que resulta en una estructura tetraédrica, como muestra la figura a continuación (la nueva ubicación de los electrones está representada por círculos punteados en la mitad de las aristas gruesas). Esto permite la formación de un enlace simple por la compartición de una esquina, un enlace doble por la compartición de una arista, y un enlace triple por compartición de una cara. También explica la libre rotación alrededor de un enlace simple y la geometría tetraédrica del metano. Es remarcable que pueda decirse que había un gano de verdad en esta idea, se mostró posteriormente que el principio de exclusión de Pauli resulta en un "hueco de Fermi" de repulsión disminuida entre un par de electrones con spin opuesto en el mismo orbital.
Véase también
- Historia de la molécula
Referencias
- Lewis, G. N. The Atom and the Molecule. J. Am. Chem. Soc. 1916, 38, 762-785. [1]
- Langmuir, I. The Arrangement of Electrons in Atoms and Molecules. J. Am. Chem. Soc. 1919, 41, 868-934.
Enlaces externos
Categorías: Enlace químico | Modelos atómicos | Teorías científicas obsoletas
Wikimedia foundation. 2010.
