- Clorocromato de piridinio
-
Clorocromato de piridinio
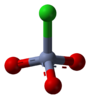
Nombre (IUPAC) sistemático Clorocromato de piridino General Otros nombres PCC Fórmula semidesarrollada C5H5NHClCrO3 Fórmula molecular n/d Identificadores Número CAS 26299-14-9 PubChem Propiedades físicas Apariencia polvo naranja cristalino Masa molar 215.56 g/mol g/mol Punto de fusión 478 K (204,85 °C) Propiedades químicas Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl clorocromato de piridinio, también denominado PCC, es un reactivo rojizo sólido utilizado para oxidar los alcoholes primarios en aldehídos y los alcoholes secundarios en cetonas. El clorocromato de piridinio no oxida plenamente alcoholes primarios al ácido carboxílico, como ocurre con el reactivo de Jones. Su principal desventaja es su toxicidad. Fue desarrollado por Elias James Corey y Suggs William en 1975.[1]
Preparación
La préparación original de Corey consiste en adicionar un equivalente de piridina a una solución de un equivalente de trióxido de cromo y de ácido clorhídrico concentrado.
-
- C5H5N + HCl + CrO3 → [C5H5NH][CrO3Cl]
Agarwal et al. propusieron una síntesis alternativa que evita la producción de cloruro de cromil (CrO2Cl2), una sustancia muy peligrosa. El trióxido de cromo se trata con cloruro de piridinio:
-
- [C5H5NH+]Cl- + CrO3 → [C5H5NH][CrO3Cl]
Propiedades y usos
El PCC se utiliza principalmente como oxidante. En particular, ha demostrado ser altamente eficaz para la oxidación de alcoholes primarios y secundarios a aldehídos y cetonas, respectivamente. Rara vez se lleva a sobreoxidación y por lo tanto no produce los ácidos carboxílicos.
Una oxidación típica de PCC implica la adición de alcohol a una suspensión de PCC en diclorometano.[2] [3] [4] Una reacción de la muestra sería:
-
- 2 C5H5NHCrO3Cl + 3 R2CHOH → 2 C5H5NHCl + "CrO1.5" + 3 R2C=O + 3 H2O
En la práctica, los subproductos de cromo se depositan con la piridina como un resíduo de alquitrán negro pegajoso, lo que puede complicar su manipulación. La adición de un material inerte absorbente permite recoger los resíduos y facilita su eliminación.
Otra reacción oxidativa notable de PCC es su conversión eficiente de los alcoholes o aldehídos insaturados a ciclohexenonas. Esta reacción en particular se conoce como ciclación catiónico oxidativo.
Referencias
- ↑ Corey, E.J.; Suggs, W. (1975). «Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds» (en inglés). Tetrahedron Lett. 16. doi:.
- ↑ Paquette, L. A.; Earle, M. J.; Smith, G. F. (1998). "(4R)-(+)-tert-Butyldimethylsiloxy-2-cyclopenten-1-one". Org. Synth.; Coll. Vol. 9: 132.
- ↑ Tu, Y.; Frohn, M.; Wang, Z.-X.; Shi, Y. (2003). "Synthesis of 1,2:4,5-Di-‘’O’’-Isopropylidene-D-erythro-2,3-hexodiulo-2,6-pyranose. A highly Enantioselective Ketone Catalyst for Epoxidation". Org. Synth. 80: 1.
- ↑ White, J. D.; Grether, U. M.; Lee, C.-S. (2005). "(R)-(+)-3,4-Dimethylcyclohex-2-en-1-one". Org. Synth. 82: 108.
Categorías:- Cromatos
- Agentes oxidantes
-
Wikimedia foundation. 2010.
