- Ácido crómico
-
Ácido crómico
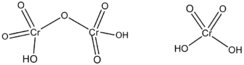
Nombre (IUPAC) sistemático Dihidroxidodioxidocromo (n. de adición)
Dihidrogeno(tetraoxidocromato) (n. de hidrógeno)General Otros nombres Ácido tetraoxocrómico (VI) (n. de Stock)
Tetraoxocromato (VI) de hidrógeno
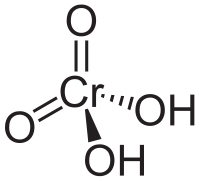
Ácido crómico (VI)Fórmula estructural (OH)2O2Cr Fórmula molecular H2CrO4 Identificadores Número CAS 7738-94-5 PubChem Propiedades físicas Estado de agregación Sólido Apariencia Cristales rojos Densidad 1201 kg/m3; 1,201 g/cm3 Masa molar 117,935820456 g/mol Punto de fusión 470 K (196,85 °C) Punto de ebullición 523 K (249,85 °C) Propiedades químicas Solubilidad en agua 1666,6 g/L Peligrosidad NFPA 704 Frases R R45 R46 R9 R24/25 R26 R35 R42/43 R48/23 Frases S S43 S45 S60 S61 Riesgos 

Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl término ácido crómico designa generalmente a una mezcla de ácido sulfúrico concentrado y dicromato de potasio o dicromato de amonio, que puede contener diversos compuestos, incluyendo trióxido de cromo sólido, CrO3. Este tipo de ácido crómico se puede utilizar como una mezcla para limpieza del vidrio.
El ácido crómico también designa al compuesto químico de fórmula H2CrO4 cuyo anhídrido es el citado trióxido de cromo, CrO3, que se suele citar también con el nombre de ácido crómico.[1] El cromo aparece en un estado de oxidación +6 (o VI) en el ácido crómico. Es un fuerte agente oxidante y corrosivo.
Contenido
Ácido crómico molecular
El ácido crómico molecular, H2CrO4, tiene mucho en común con el ácido sulfúrico, H2SO4. Ambos se clasifican como ácidos fuertes, aunque sólo el primer protón se pierde fácilmente.
- H2CrO4
 [HCrO4]- + H+
[HCrO4]- + H+
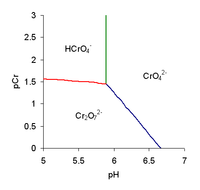
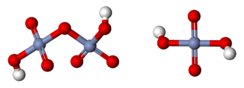
El valor del pKa para este equilibrio no es bien conocido. Los valores reportados varían entre alrededor de -0,8 a 1,6.[2] El valor para fuerza iónica nula es difícil de determinar porque la mitad de la disociación se produce sólo en una solución muy ácida, a un pH de cero, es decir, con una concentración de ácido de alrededor de 1 mol/L. Una complicación adicional es que el ion [HCrO4]- tiene una marcada tendencia a dimerizarse, con la pérdida de una molécula de agua, para formar el ion dicromato, [Cr2O7]2-
- 2 [HCrO4]-
 [Cr2O7]2- + H2O, log KD = 2,05.
[Cr2O7]2- + H2O, log KD = 2,05.
Además, el ion dicromato puede protonarse (aceptar un protón).
- [HCr2O7]-
 [Cr2O7]2- + H+, pK = 1.8[3]
[Cr2O7]2- + H+, pK = 1.8[3]
El valor de pK para esta reacción demuestra que se puede despreciar para pH> 4.
La pérdida del segundo protón se produce en el rango de pH=8,4 por lo que el ion [HCrO4]- es un ácido débil.
El ácido crómico molecular podría, en principio, obtenerse mediante la adición de trióxido de cromo y agua (véase la fabricación de ácido sulfúrico).
- CrO3 + H2O
 H2CrO4
H2CrO4
pero en la práctica ocurre la reacción inversa, cuando el ácido crómico molecular se deshidrata. Esto es lo que ocurre cuando el ácido sulfúrico concentrado se agrega a una solución de dicromato. Al principio, los cambios de color de naranja (dicromato) a rojo (ácido crómico) y más tarde precipitan cristales de color rojo oscuro, de trióxido de cromo, sin cambio de color adicional. Los colores se deben a complejos de transferencia de carga.
El trióxido de cromo es el anhídrido del ácido crómico molecular. Se trata de un ácido de Lewis y puede reaccionar con una base de Lewis, como la piridina en un medio no acuoso como diclorometano (reactivo de Collins).
Ácido dicrómico
El ácido dicrómico, H2Cr2O7, (estructura ilustrada arriba a la derecha) es la forma totalmente protonada del ion dicromato y también puede ser visto como el producto de la adición de trióxido de cromo al ácido crómico molecular.
Está probablemente presente en las mezclas de ácido crómico usado para limpieza del vidrio junto con la mezcla de ácido crómico y ácido sulfúrico H2CrSO7 o en las mezclas de trióxido de cromo y agua.[4]
Se ha descrito la formación de complejos de este ácido con tres moléculas de óxido de tri-n-octilfosfina (TOPO).[5]
Usos
El ácido crómico es un producto intermedio que aparece en el proceso de cromado, y también se utiliza en los esmaltes de cerámica y coloreado del vidrio. Debido a la fuerte acción oxidante de las disoluciones de ácido crómico en ácido sulfúrico (también conocidas como mezcla sulfocrómica o ácido cromosulfurico), pueden ser utilizadas para limpiar el material de vidrio de laboratorio, en particular de los residuos orgánicos que de otro modo resulten insolubles. Esta aplicación ha disminuido debido a las preocupaciones ambientales.[6] Además, el ácido deja trazas de iones Cr (III) paramagnéticos que pueden interferir con determinadas aplicaciones, como la Espectroscopia de resonancia magnética nuclear (RMN). Esto es especialmente importante en el caso de los tubos de RMN.[7]
El ácido crómico también ha sido ampliamente utilizado en la industria de la reparación de instrumentos musicales metálicos, debido a su capacidad para "iluminar" el latón en bruto. Un baño de ácido crómico deja tras de sí una pátina de color amarillo brillante en el bronce. Debido a la creciente preocupación por la salud y el medio ambiente, ha disminuido el uso de este producto químico en las tiendas de su reparación.
Reacciones
El ácido crómico es capaz de oxidar muchos tipos de compuestos orgánicos y por ello se han desarrollado distintas variedades de este reactivo:
El ácido crómico en disolución acuosa de ácido sulfúrico y acetona es conocido como el reactivo de Jones, que oxida a los alcoholes primarios y secundarios hasta ácidos carboxílicos y cetonas, respectivamente, mientras que rara vez afectan a enlaces insaturados.[8]
El clorocromato de piridinio se genera a partir de trióxido de cromo y cloruro de piridinio. Este reactivo convierte los alcoholes primarios en los aldehídos correspondientes (R-CHO).[8]
El reactivo de Collins es un aducto de trióxido de cromo y piridina utilizado para diversas oxidaciones.
El cloruro de cromilo, CrO2Cl2 es un compuesto molecular bien definido que se genera a partir del ácido crómico.
Ejemplos de transformaciones
- La oxidación de los metilbencenos a ácido benzoico.[9]
- Escisión oxidativa de indeno para dar ácido homoftálico.[10]
- Oxidación de un alcohol secundario a su correspondiente cetona (como en la ciclooctanona[11] y nortriciclanona[12] )
Uso en análisis orgánico cualitativo
En química orgánica, las soluciones diluidas de cromo hexavalente puede ser utilizadas para oxidar alcoholes primarios o secundarios a los correspondientes aldehídos y cetonas. Los grupos OH de los alcoholes terciarios no se ven afectados. A causa de que la oxidación se muestra por un cambio de color de naranja a un color azul-verdoso, el ácido crómico se utiliza como una prueba de análisis cualitativo de la presencia de alcoholes primarios o secundarios.[8]
Reactivos alternativos
En las oxidaciones de alcoholes o aldehídos para dar ácidos carboxílicos, el ácido crómico es uno de los diversos reactivos posibles, entre los que existen algunos que son catalíticos. Por ejemplo, las sales de níquel (II) catalizan la oxidación por hipoclorito de sodio.[13] Los aldehídos se oxidan con relativa facilidad para dar ácidos carboxílicos, y es suficiente el empleo de agentes oxidantes suaves. Los compuestos de plata (I) se utilizan con este propósito. Cada oxidante ofrece ventajas y desventajas.
Seguridad
Los compuestos de cromo hexavalente son tóxicos y cancerígenos. Por esta razón, las oxidaciones mediante el ácido crómico no se utilizan a escala industrial.
Referencias
- Alcohols from Carbonyl Compounds: Oxidation-Reduction and Organometallic Compounds (PDF) (en inglés)
- ↑ Chromium trioxide. Chemicalland21.com
- ↑ IUPAC SC-Database Una base de datos publicados de constantes de equilibrio de complejos de metal y ligandos.
- ↑ Brito, F.; Ascanioa, J.; Mateoa, S.; Hernándeza, C.; Araujoa, L.; Gili, P.; Martín-Zarzab, P.; Domínguez, S.; Mederos, A. (1997). «Equilibria of chromate(VI) species in acid medium and ab initio studies of these species». Polyhedron 16 (21): pp. 3835–3846. doi:.
- ↑ G.F. Liptrot. "Modern Inorganic Chemistry". 4ª Fdición. Londres, (1983).
- ↑ Extraction equilibria of chromium(VI) from sulfuric acid solutions with tri-n-octylphosphine oxide. Huang TC, Huang CC, Chen DH. Journal of Chemical Technology and Biotechnology, 73(1), pág. 43-53. 1998. (en inglés)
- ↑ J. M. McCormick (30-06-2006). «Cleaning Glassware». Truman State University.
- ↑ «NMR-010: Proper Cleaning Procedures for NMR Sample Tubes». Wilmad. Consultado el 27-06-2008.
- ↑ a b c Freeman, F. "Chromic Acid" Encyclopedia of Reagents for Organic Synthesis (2001) John Wiley & Sons, doi 10.1002/047084289X.rc164
- ↑ Kamm O.; Matthews, A. O. (1941). "p-Nitrobenzoic Acid". Org. Synth.; Coll. Vol. 1: 392.
- ↑ Grummitt, O.; Egan, R.; Buck, A.. "Homophthalic Acid and Anhydride". Org. Synth.; Coll. Vol. 3: 449 (1955.
- ↑ Eisenbraun, E. J.. "Cyclooctanone". Org. Synth.; Coll. Vol. 5: 310 (1973.
- ↑ Meinwald, J.; Crandall, J.; Hymans W. E.. "Nortricyclanone". Org. Synth.; Coll. Vol. 5: 866.
- ↑ J. M. Grill, J. W. Ogle, S. A. Miller (2006). «An Efficient and Practical System for the Catalytic Oxidation of Alcohols, Aldehydes, and α,β-Unsaturated Carboxylic Acids». J. Org. Chem. 71 (25): pp. 9291–9296. doi:. PMID 17137354.
Enlaces externos
- International Chemical Safety Card 1194 Ficha de seguridad (en inglés)
- NIOSH Pocket Guide to Chemical Hazards 0138 Ficha de seguridad (en inglés)
- IARC "Chromium and Chromium compounds" (en inglés)
Categorías:- Agentes oxidantes
- Compuestos de hidrógeno
- Cromatos
- H2CrO4
Wikimedia foundation. 2010.