- Fórmula química
-
 Diferentes fórmulas del peróxido de hidrógeno: empírica,molecular y semidesarrollada.
Diferentes fórmulas del peróxido de hidrógeno: empírica,molecular y semidesarrollada.
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura o formulación química. Existen varios tipos de fórmulas químicas:[1]
Contenido
Fórmula empírica
La fórmula empírica indica el tipo de átomos presentes en un compuesto y la relación entre el número de átomos de cada clase. Siempre indica las proporciones enteras más pequeñas entre los átomos de cada clase.[2] En compuestos covalentes, se obtiene simplificando los subíndices de la fórmula, si ello es posible, dividiéndolos por un factor común. Así la fórmula empírica de la glucosa es CH2O, lo cual indica que por cada átomo de C, hay dos átomos de H y un átomo de O. Los subíndices siempre son números enteros y si es igual a 1, no se escribe.
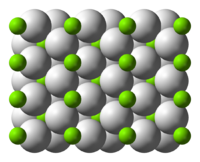
En compuestos iónicos la fórmula empírica es la única que podemos conocer, e indica la proporción entre el número de iones de cada clase en la red iónica. En el hidruro de magnesio, hay dos iones hidruro (bolas blancas, en el diagrama) por cada ion magnesio (bolas verdes), luego su fórmula empírica es MgH2.
En compuestos no-estequiométricos, como ciertos minerales, los subíndices pueden ser números decimales. Así,el óxido de hierro (II) tiene una fórmula empírica que varía entre Fe0,84O y Fe0,95O,lo que indica la presencia de huecos, impurezas y defectos en la red.
Fórmula molecular
La fórmula molecular, indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.
Fórmula semidesarrollada
La fórmula semidesarrollada es similar a la anterior pero indicando los enlaces entre los diferentes grupos de átomos para resaltar, sobre todo, los grupos funcionales que aparecen en la molécula. Es muy usada en química orgánica, donde se puede visualizar fácilmente la estructura de la cadena carbonada y los diferentes sustituyentes. Así, la glucosa tendría la siguiente fórmula semidesarrollada:
CH2OH − CHOH − CHOH − CHOH − CHOH − CHO
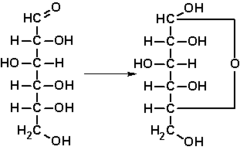 Fórmulas desarrolladas de la D-glucosa y el D-glucopiranósido.[3]
Fórmulas desarrolladas de la D-glucosa y el D-glucopiranósido.[3]
Fórmula desarrollada
La fórmula desarrollada es más compleja que la fórmula semidesarrollada. Indica todos los enlaces representados sobre un plano cartesiano, que permite observar ciertos detalles de la estructura que resultan de gran interés.
Fórmula estructural
La fórmula estructural es similar a las anteriores pero señalando la geometría espacial de la molécula mediante la indicación de distancias, ángulos o el empleo de perspectivas en diagramas bi- o tridimensionales.[4]
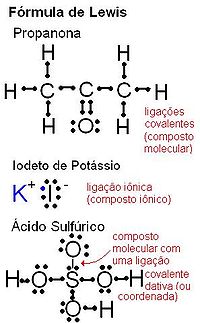
Fórmula de Lewis
La fórmula de Lewis, diagramas de Lewis o estructura de Lewis de una molécula indica el número total de átomos de esa molécula con sus respectivos electrones de valencia (representados por puntos entre los átomos enlazados o por una rayita por cada par de electrones).[5] No es recomendable para estructuras muy complejas.
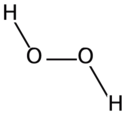
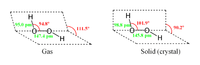
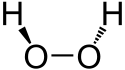
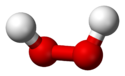
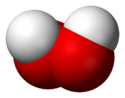
Fórmula desarrollada
de H2O2Estructura mostrando
ángulos y distanciasFórmula estructural 2D
del H2O2Modelo de bolas
y varillas de H2O2Modelo de bolas 3D (Van der Waals) En un diagrama 2D, se aprecia la orientación de los enlaces usando símbolos especiales. Una línea continua representa un enlace en el plano; si el enlace está por detrás, se representa mediante una línea de puntos; si el enlace está por delante, se indica con un símbolo en forma de cuña triangular. A veces se emplean otro tipo de convenios o proyecciones para grupos de compuestos específicos (proyección de Newman, diagramas de Tollens, etc). En los diagramas adjuntos, se observan algunos de estas fórmulas estructurales.
También hay diagramas 3D como la estructura o fórmula de esqueleto (o de líneas y ángulos).
A veces, se prefiere el uso de modelos moleculares en 3D, como:
- Modelo de esqueleto, de armazón: no se dibujan los átomos de C e H.
- Modelo de bolas y barras, o de bolas y varillas.
- Modelo de bolas, compacto o espacial sólido.
- Modelos poliédricos: los átomos se representan por tetraedros, octaedros... que se unen por sus vértices y permiten ciertos giros o torsiones.
Son numerosas las aplicaciones informáticas para crear estructuras (ChemDraw), y visualizarlas (Jmol). Permiten dibujar, rotar estas estructuras y observarlas desde distinto puntos de vista.
Véase también
 Wikcionario tiene definiciones para fórmula química.Wikcionario
Wikcionario tiene definiciones para fórmula química.Wikcionario- Formulación química
- Elemento químico
- tabla periódica
- Notación nuclear
- Modelos moleculares
Referencias
- ↑ Ralph S. Petrucci, William S. Harwood y F. Geoffrey Herring, General Chemistry, 8th Edition (Prentice-Hall 2002), cap 3.
- ↑ Química: la ciencia central. Theodore L. Brown, Bruce E. Bursten, Julia R. Burdge. 9ª ed. Pearson Educación, 2004. ISBN: 9702604680. Pág. 50
- ↑ Química orgánica. Stephen J Weininger, Frank R. Stermitz. Editorial Reverté, 1988. ISBN: 842917527X Pág. 1289
- ↑ Química orgánica. John McMurry. 6ª ed. Cengage Learning Editores, 2005. ISBN: 9706863540 Pág.56 y ss.
- ↑ Fórmula de Lewis. En: Diccionario de química física. J. M. Costa. Ediciones Díaz de Santos, 2005. ISBN: 8479786914
Categorías:- Química
- Representación de moléculas
Wikimedia foundation. 2010.