- Ninhidrina
-
Ninhidrina
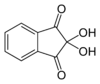
Nombre (IUPAC) sistemático 2,2-Dihydroxyindane-1,3-dione General Fórmula semidesarrollada C9-H6-O4 Fórmula molecular n/d Identificadores Número CAS 485-47-2 ChemSpider 9819 Propiedades físicas Densidad 862 kg/m3; 0,862 g/cm3 Masa molar n/d Punto de fusión 523 K (249,85 °C) Propiedades químicas Riesgos Más información MSDS externos Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa ninhidrina es un poderoso agente reactivo común para visualizar las bandas de separación de aminoácidos por cromatografía o electroforesis, también es utilizada con fines cuantitativos para la determinación de aminoácidos[1] for stable isotope analysis in order to help reconstruct the palaeodiet of cave bears.[2] Reacciona con todos los aminoácidos alfa cuyo pH se encuentra entre 4 y 8, dando una coloración que varía de azul a violeta intenso. Este producto colorido (llamado púrpura de Ruhemann) se estabiliza por resonancia, la coloración producida por la ninhidrina es independiente de la coloración original del aminoácido.[3]
Esta prueba es positiva tanto para proteínas como para aminoácidos. en aquellos casos donde no da positiva la prueba de biuret y da positiva la de ninhidrina, indica que no hay proteinas, pero si hay aminoacidos libres.[4]
Reactividad
El átomo de carbono de un carbonilo tiene una carga positiva parcial, por lo que el C central de de un 1,2,3-tricarbonilo es menos estable y más electrofílico que una cetona simple. En la mayoría de los compuestos, un carbonilo es más estable que la forma dihidroxi (hidrato). Sin embargo, la ninhidrina es un hidrato de carbono estable del C central porque esta forma no tiene el efecto desestabilizador de los centros adyacentes de carbonilo parciales positivos. El indano-1 ,2,3 -triona reacciona rápidamente con nucleófilos.
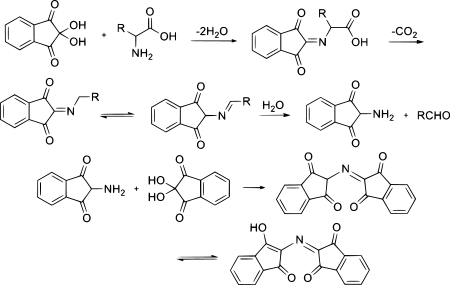
Tenga en cuenta que con el fin de generar la ninhidrina cromóforo, la amina se condensa con una molécula de ninhidrina para dar una base de Schiff. Así pues, sólo amonia y aminas primarias proceden más allá de este paso. En este paso, debe haber también un protón alfa (* H en el diagrama) para la transferencia de base de Schiff, por lo que una amina adyacente a un carbono terciario no puede ser detectada por la prueba de ninhidrina. La reacción de ninhidrina con aminas secundarias da una sal de iminio, que es también de color, y esto es generalmente de color amarillo-anaranjado en color.
Es una de las reacciones mas sensibles para identificar aminoacidos en general, ya que detecta una parte de aminoacido en 1 500 000 partes de agua. Aminoacidos y muchas aminas primarias dan un color violeta caracteristico. La prolina da coloracion amarilla. Por su sensibilidad esta reaccion se emplea para valoracion cuantitativa de amonoacidos por colorimetria. La valoracion de aminoacidos en orina, por ejemplo, tiene importancia en medicina ya que en algunas enfermedades como hepatopatias, infecciones agudas o diabetes mellitus en las que se presente hiperaminoacidemia, estas se ven acompañadas por aminoaciduria paralela. Algunas enfermedades metabolicas congenitas dan lugar a la eliminacion anormal de algunos aminoacidos en la orina (p ej fenilcetonuria).
Bibliografía
- Armstrong, F Bioquímica. Editorial Reverte, S.A. Barcelona España. 1982
Gonzáles Rodriguez, Lucia . Manual de Laboratorio Bioquímica I. Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional de Colombia. Bogotá 1997.
Referencias
- ↑ C. I. Keeling, D. E. Nelson, K. N. Slessor, Archaeometry 41 151 (1999)
- ↑ C. I. Keeling, D. E. Nelson, Oecologia 127 495 (2001)
- ↑ E. Kaiser, R. L. Colescott, C. D. Bossinger, P. I. Cook, Analytical Biochemistry 34 595 (1970)
- ↑ http://www.bergen.org/EST/Year5/fingerprint.htm
Wikimedia foundation. 2010.