- Fluorescencia
-
Fluorescencia
La fluorescencia es la propiedad de una sustancia para emitir luz cuando es expuesta a radiaciones del tipo ultravioleta, rayos catódicos o rayos X. Las radiaciones absorbidas (invisibles al ojo humano), son transformadas en luz visible, o sea, de una longitud de onda mayor a la incidente.
En el proceso, una molécula absorbe un fotón de alta energía, el cual es emitido como un fotón de baja energía (mayor longitud de onda). La diferencia de energía entre la absorción y la emisión, es disipada como calor (vibraciones moleculares). Todo el proceso es muy corto (millonésimas de segundo) y este tiempo es la principal diferencia con otro conocido fenómeno luminoso, la fosforescencia.
Las sustancias que producen este tipo de radiación se denominan fluoritas, mientras que el fenómeno en sí mismo, se debe a la presencia de materia orgánica o de iones de tierras raras.
Sin embargo, en una muestra de minerales que poseen propiedades fluorescentes, no todos ellos, incluso los que se han extraído de un mismo lugar, presentan la característica luminiscencia. Por otro lado existe una amplia variedad de colores, dependiendo de la longitud de onda emitida.
Contenido
Ecuaciones
Fotoquímica
La fluorescencia ocurre cuando una molécula, átomo o nanostructura vuelve a su estado fundamental después de haber estado excitada eléctricamente.
Excitación:
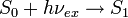
Fluorescencia (emisión) :
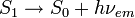 ; aquí, hν es un término genérico para la energía del fotón con h = constante de Planck y ν = frecuencia de la luz. (Las frecuencias específicas de la luz excitada y emitida son dependientes en el sistema particular.)
; aquí, hν es un término genérico para la energía del fotón con h = constante de Planck y ν = frecuencia de la luz. (Las frecuencias específicas de la luz excitada y emitida son dependientes en el sistema particular.)El estado S0 es llamado estado fundamental de la molécula fluorescente y S1 es su primer estado de excitación (electrónico).
Una molécula en estado de excitación, S1, puede relajarse por diferentes formas. Esta puede sufrir una 'relajación no radioactiva' en la cual la energía de excitación es disipada como calor (vibraciones) al solvente. Las moléculas orgánicas excitadas también pueden relajarse mediante conversión a un estado triplete el cual posteriormente se relaja vía fosforescencia o mediante un segundo paso no-radioactivo de relajación.
La relajación de un estado S1 también puede ocurrir a través de una interacción con una segunda molécula mediante apagamiento fluorescente. El oxígeno molecular (O2) es muy eficiente quitando la fluorescencia debido a su inusual estado triplete fundamental.
Las moléculas que se excitan a través de la absorción de luz o por via de un proceso diferente (ej. Como el producto de una reacción) pueden transferir energía a una segunda molécula ‘sensibilizada’, la cual es conducida a su estado de excitación y puede entonces emitir fluorescencia.
Rendimiento cuántico
El rendimiento cuántico de fluorescencia muestra la eficiencia del proceso fluorescente. Este rendimiento es definido como la proporción del número de fotones emitidos sobre el número de fotones absorbidos.
El máximo rendimiento cuántico de fluorescencia es 1.0 (100%); cada fotón absorbido resulta en un fotón emitido. Compuestos con rendimientos cuánticos de 0.10 son todavía considerados bastante fluorescentes. Otra forma de definir el rendimiento cuántico de fluorescencia es mediante las tasas a las cuales decae el estado de excitación:
Donde kf es la tasa de emisión espontánea de radiación y
∑ ki i es la suma de todas las tasas de decaimiento. Otras tasas de decaimiento del estado de excitación son causadas por mecanismos diferentes a la emisión de fotones y son por lo tanto con frecuencia llamadas “tasas no-radioactivas”, las cuales pueden incluir:desactivación de colisión dinámica, interacción de campo cercano dipolo-dipolo (o Transferencia de energía de resonancia), conversión interna y paso de intersistema. Por lo tanto, si la tasa de cualquier vía cambia, esto afectaría tanto el tiempo de vida del estado excitado y como el rendimiento cuántico de fluorescencia.
El rendimiento cuántico de fluorescencia es medido al compararlo con un estándar de cuantología conocida; la sal de quinina, sulfato de quinina, en una solución de ácido sulfúrico es un estándar común de fluorescencia.
Tiempo de vida
El tiempo de vida de la fluorescencia se refiere al tiempo promedio que dura la molécula en su estado de excitación antes de emitir un fotón. La fluorescencia típicamente sigue a cinética de primer orden:
donde
![\left[S 1 \right]](/pictures/eswiki/57/936b16036b159a928c3be3d4aa456026.png) es la concentración de moléculas en estado de excitación en el tiempo t,
es la concentración de moléculas en estado de excitación en el tiempo t, ![\left[S 1 \right]_0](/pictures/eswiki/50/2bdcf47864466e1b891ffe8501a818fa.png) es la concentración inicial y Γ es la tasa de decaimiento o el inverso del tiempo de vida de la fluorescencia. Este es un ejemplo de decaimiento exponencial. Varios procesos radiativos y no-radiativos pueden despoblar el estado excitado. En ese caso, la tasa de decaimiento total es la suma de todas las tasas:
es la concentración inicial y Γ es la tasa de decaimiento o el inverso del tiempo de vida de la fluorescencia. Este es un ejemplo de decaimiento exponencial. Varios procesos radiativos y no-radiativos pueden despoblar el estado excitado. En ese caso, la tasa de decaimiento total es la suma de todas las tasas:- Γtot = Γrad + Γnrad
donde Γtot es la tasa de decaimiento total, Γrad es la tasa de decaimiento radiativo y Γnrad la tasa de decaimiento no-radiativo. Es muy similar a una reacción química de primer orden en la cual la tasa constante de primer orden es la suma de todas las tasas (un modelo cinético paralelo). Si la tasa de emisión espontánea, o cualquiera de las otras tasas son rápidas, el tiempo de vida es corto. Para compuestos fluorescentes que emitan fotones con energías desde el UV hasta el cercano infrarrojo, los tiempos típicos de decaimiento del estado excitado se encuentran entre 0.5 a 20 nanosegundos. El tiempo de vida fluorescente es un parámetro importante para aplicaciones prácticas de la fluorescencia como transferencia de energía de resonancia.
Reglas
Existen algunas reglas que reencargan de la fluorescencia. La Regla de Kasha dicta que el rendimiento cuántico de luminiscencia es independiente de la longitud de onda de la radiación.
Esto no es siempre cierto y se contradice severamente en muchas moléculas simples. Una declaración un tanto más confiable, aunque aún con excepciones, podría ser que el espectro de fluorescencia muestra muy poca dependencia en la longitud de onda de la radiación.
El ‘‘diagrama Jablonski’’ describe la mayor parte del mecanismo de relajación para las moléculas en estado excitado.
Aplicaciones
Existen muchos compuestos naturales y sintéticos que exhiben fluorescencia, y tienen un número de aplicaciones. Algunos animales del fondo del océano, como los ojiverde, usan la fluorescencia.
Iluminación
El común tubo fluorescente depende de la fluorescencia. Dentro del tubo de vidrio hay un vacío parcial y una pequeña cantidad de mercurio. Una descarga eléctrica en el tubo causa que los átomos de mercurio emitan luz. La luz emitida se encuentra en el rango ultravioleta (UV), es invisible, e inofensiva para la mayoría de los organismos vivientes. El tubo es revestido con una capa de un material fluorescente llamado el phosphor, el cual absorbe la luz ultravioleta y reemite la luz visible. La iluminación fluorescente es energéticamente muy eficiente comparada con la tecnología incandescente, pero el espectro producido puede hacer que ciertos colores no parezcan naturales.
A mediados de los 90’s, el diodo emisor de luz (LED) blanca estuvo disponible, el cual funciona a través de un proceso similar. Típicamente, el actual semiconductor emisor de luz produce luz en la parte azul del espectro, la cual choca con un compuesto phosphor depositado en el chip; el phosphor se pone fluorescente desde la parte verde hasta la parte azul del espectro. La combinación de la luz azul que pasa a través del phosphor y la luz emitida por el mismo produce una emisión de luz blanca.
Se dice que las modernas lámparas de vapor de mercurio del alumbrado público han evolucionado de la lámpara fluorescente.
La Lámpara compacta fluorescente (CFL) es la misma que cualquier lámpara fluorescente típica con ventajas. Esta es usada para reemplazar lámparas incandescentes en muchas aplicaciones. Producen un cuarto del calor por lumen como los bombillos incandescentes pero duran como cinco veces más. Estas lámparas contienen mercurio y deben ser manejadas y dispuestas con cuidado. Las desventajas de que estas lámparas tengan un balastro es que no encajan adecuadamente en todos los aparatos de luz. Todas las lámparas fluorescentes tienen un retraso significativo al momento de ser encendidas comparadas con las lámparas incandescentes, una desventaja en algunas aplicaciones. Adicionalmente, la tecnología que les permite ser usadas también reduce significativamente su vida útil y su fiabilidad en aplicaciones de oscurecimiento.
Química analítica
La fluorescencia puede ser detectada con un detector selector de longitud de onda para encontrar compuestos presentes en una HPLC. Además, las placas de una TLC pueden ser visualizadas si los compuestos o los reactivos de color son fluorescentes. La fluorescencia es más efectiva cuando hay una gran proporción de átomos en los niveles bajos de energía en una distribución de Boltzmann. Existe entonces una mayor probabilidad que los átomos con energía baja sean excitados y liberen a su vez fotones, permitiendo así un análisis más eficiente.
Las huellas dactilares pueden ser visualizadas con compuestos fluorescentes como ninhidrina.
Bioquímica y medicina
Las moléculas biológicas pueden ser marcadas con un grupo químico fluorescente (fluorocromo) mediante una reacción química simple, lo cual permite una detección sensible y cuantitativa de la molécula. Algunos ejemplos:
- La microscopía de fluorescencia de tejidos, células o estructuras subcelulares es lograda marcando el anticuerpo con un fluorocromo y permitiendo que éste encuentre su antígeno correspondiente presente en la muestra. Al marcar varios anticuerpos con diferentes fluorocromos se puede lograr la visualización de múltiples objetivos dentro de una misma imagen.
- Secuenciación automática de ADN por el método de terminación de la cadena: cada uno de los cuatro ddNTP’s se encuentra marcado con un fluorocromo específico de tal forma que se generan cadenas de diferente longitud que al ser sometidas a una fuente de UV se puede determinar la base nitrogenada terminal de cada cadena debido a la longitud de onda emitida característica de cada fluorocromo.
- Detección de ADN: el compuesto bromuro de etidio, libre de cambiar su conformación en solución, tiene poca fluorescencia. La fluorescencia del bromuro de etidio se aumenta enormemente cuando se une al ADN, de tal forma que este compuesto es muy útil para visualizar la localización de fragmentos de ADN en el método de electroforesis en geles de agarosa. El bromuro de etidio puede ser tóxico por tanto, una alternativa más segura es teñir con SYBR Green.
- Microarreglos
- Inmunología: los sitios de unión de un anticuerpo a un espécimen microscópico por ejemplo, pueden ser vistos, e incluso cuantificados, empleando la fluorescencia si se le ha unido previamente un grupo químico fluorescente al anticuerpo específico.
- La fluorescencia ha sido empleada para el estudio de la estructura y conformación del ADN, así mismo como de proteínas, con técnicas como la transferencia de energía de resonancia, la cual mide distancias a nivel de angstroms. Lo anterior es especialmente importante en complejos de biomoléculas múltiples.
- FACS (Citometría)
- La Proteína Verde Fluorescente (GFP), de la meduza Aequorea victoria, se ha convertido en una herramienta de investigación muy importante. GFP y otras proteínas relacionadas son usadas como reporteros de un sin numero de eventos biológicos incluyendo aquellos de localización subcelular. Los niveles de expresión génica son medidos en algunas ocasiones uniendo el gen de producción de GFP con el gen de interés.
También, diversas moléculas biológicas tienen fluorescencia intrínseca y por tanto, pueden ser empleadas sin necesidad de unirlas a una etiqueta química. Algunas veces, esta fluorescencia intrínseca cambia cuando la molécula se encuentra en un ambiente específico, de tal forma que la distribución o el ligamiento de la molécula pueden ser medidos. La bilirrubina, por ejemplo, es altamente fluorescente cuando se une a la albúmina sérica en un sitio específico. La protoporfirina zinc, la cual se encuentra en las células sanguíneas cuando la producción del grupo hemo es inhibido por la existencia de plomo o la ausencia de hierro en la sangre, tiene una fuerte fluorescencia y puede ser, por tanto, empleada para detectar estos problemas.
El número de aplicaciones de la fluorescencia ha ido creciendo en el campo de la biomedicina, la biología y en otras ciencias relacionadas. Los métodos de análisis en estos campos también han ido aumentando: FLIM, FLI, FLIP, CALI, FLIE, FRET, FRAP, FCS, PFRAP, smFRET, FRIPS, SHRIMP or TIRF. Muchas de estas técnicas se basan en los microscopios de fluorescencia. Los microscopios utilizan fuentes de luz de alta intensidad, usualmente lámparas de mercurio o xenón, LED’s, o láseres, para generar fluorescencia en las muestras bajo observación. Posteriormente, los filtros ópticos separan la luz excitada de la fluorescencia emitida, para permitir que sea detectada a simple vista, empleando una cámara o utilizando algún otro detector de luz como espectrógrafos, etc. Muchas investigaciones se están llevando a cabo para mejorar la capacidad de esos microscopios, las sondas fluorescentes usadas, y las aplicaciones de las mismas. De observación particular se encuentran los microscopios confocales, los cuales utilizan un poro para lograr secciones ópticas, proporcionando una vista cuantitativa y en 3D de la muestra.
Gemología, mineralogía, geología y ciencias forenses
Las gemas, los minerales, las fibras y muchos otros materiales, que pueden ser encontrados en medicina forense, pueden tener una fluorescencia distintiva o pueden fluorecer diferente bajo luz utravioleta de onda corta, de onda larga, o rayos X’s: Muchos tipos de calcita y ámbar presentarán fluorescencia bajo luz ultravioleta de onda corta. Los rubíes, las esmeraldas y el diamante Hope exhiben fluorescencia roja bajo luz UV de onda corta; los diamantes también emiten luz bajo rayos X’s.
El petróleo emite fluorescencia en un rango de colores, desde el marrón mate para aceites pesados y alquitrán hasta el amarillento y blanco azulado para los aceites muy livianos y condensados. Este fenómeno es usado en perforaciones hechas para la exploración de petróleo permitiendo identificar pequeñas cantidades de crudo en las perforaciones y en el centro de las muestras.
Líquidos orgánicos
Los líquidos orgánicos, como las mezclas de antraceno en benceno o tolueno en los mismos solventes, emiten fluorescencia con radiación UV o rayos gamma. Los tiempos de decaimiento de esta fluorescencia son del orden de nanosegundos ya que la duración de la luz depende del tiempo de vida de los estados excitados del material fluorescente, en este caso antraceno.
Véase también
- Lámpara fluorescente
- Luz negra
- ESpectroscopía de fluorescencia
- Fosforescencia
- Fluorescencia de rayos X's
Enlaces externos
- Fluorophores.org The database of fluorescent dyes
- Principios de base de la espectroscopia de fluorescencia
- Fluorescence Applications Spanning the UV, Vis, and NIR by Photon Technology International Inc.
- [1] Fluorescence Applications & Instruments Slideshows | HORIBA Jobin Yvon
- Interactive Fluorescence Dye and Filter Database Carl Zeiss Interactive Fluorescence Dye and Filter Database.
- ISS Fluorescence Lifetime Standards Tables
- ISS Fluorescence Probes Data Tables
- The Fluorescence Foundation
- Fluorophores.org The database of fluorescent dyes
- Jablonski diagram
- Fluorescence on Scienceworld
- Basic Concepts in Fluorescence
- Scorpion detection using UV LEDs
- Immunofluorescence Protocol
- An example of use of fluorescence in generating cellular images
- Difference between flourescence and glow in the dark
- More examples how the fluorescence can be used
- Fluorescence in digital Photography
- The Influence of Fluorescence in the World of Art
- Fluorescence control by Photonic Crystals - ICMM
- The Fluorescent Mineral Society
- Fluorescence in Practice
- Laboratory for Fluorescence Dynamics
- "A nano-history of fluorescence" lecture by David Jameson
- Exitation and emmision spectra of various fluorescent dyes
- Manawatu Microscopy - first known collaboration environment for Microscopy and Image Analysis featuring Open DataBase of Fluorescent Dyes and Stains and their applications.
Categoría: Espectroscopia
Wikimedia foundation. 2010.



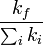
![\left[S 1 \right] = \left[S 1 \right]_0 e^{-\Gamma t},](/pictures/eswiki/52/4ccde671c1c69df2fb94756561983024.png)

