- Síntesis de pirimidina de Biginelli
-
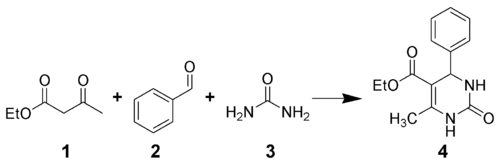
La Síntesis de Biginelli es un método de síntesis orgánica en donde se obtiene un derivado de la pirimidina. Consiste en una reacción que emplea un β-cetoéster (En el ejemplo es acetoacetato de etilo, 1), un arilaldehído (Benzaldehído 2 en el ejemplo) y urea 3.[1] [2] [3] [4] [5] [6]
Esta reacción fue desarrollada por Pietro Biginelli en 1891. La reacción puede ser catalizada por un ácido de Brønsted y/o por un ácido de Lewis, por ejemplo trifluoruro de boro.[7] Se ha publicado diversos protocolos de síntesis en fase sólida que emplean diferentes combinaciones vinculadas.[8] [9]
En la industria farmacéutica las dihidropirimidinonas (Productos de la reacción de Biginelli) son utilizadas como bloqueadores del canal de calcio.[10] y como agentesantihipertensivos.
Mecanismo de reacción
El mecanismo de la reacción de Biginelli es una serie de reacciones bimoleculares que conducen a la dihidropirimidinona deseada.[11]
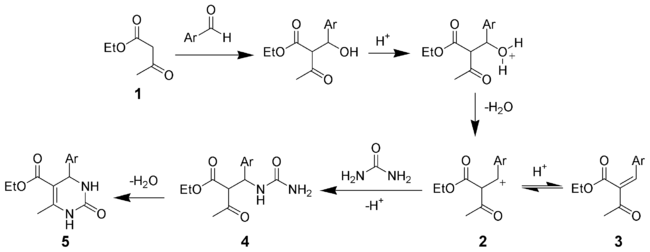
De acuerdo al mecanismo propuesto por Sweet en 1973, la primera reacción es la condensación aldólica entre el acetoacetato de etilo 1 y el benzaldehído. Éste es el paso limitante de la primera reacción, en donde se produce la eliminación del hidroxilo resultante, que conduce a los estados 2 y 3. La segunda reacción es la adición nucleofílica de la urea en donde se obtiene el intermediario 4, que rápidamente se deshidrata para dar el producto deseado 5.[12]
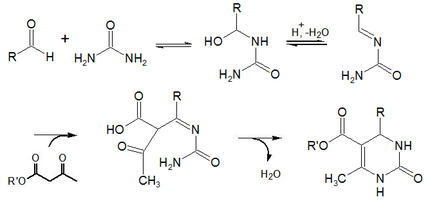
Este mecanismo fue sustituido por Kappe en 1997.
Este mecanismo propone que primero la urea forma una unión imina (una N-alquilidenurea). Posteriormente, el acetoacetato de etilo se condensa con la imina formada. La última reacción consiste en la formación de la enamina a partir de el grupo amida y el carbonilo disponibles.[13] [14]
Avances en la reacción de Biginelli
En 1987, Atwal et al.[15] reportó una modificación a la reacción de Biginelli que genera un mayor rendimiento.<"Atul Kumar". Se ha reportado la primera síntesis enzimática de la reacción de Biginelli por medio de una levadura.[16]
Referencias
- ↑ Biginelli, P. Ber. 1891, 24, 1317 & 2962.
- ↑ Biginelli, P. Ber. 1893, 26, 447.
- ↑ Zaugg, H. E.; Martin, W. B. Org. React. 1965, 14, 88. (Review)
- ↑ Kappe, C. O. Tetrahedron 1993, 49, 6937-6963. (Review)
- ↑ C. Oliver Kampe: The Biginelli Reaction, in: J. Zhu and H. Bienaymé (Editor): Multicomponent Reactions, Wiley-VCH, Weinheim, 2005, ISBN 978-3-527-30806-4.
- ↑ Kappe, C. O.; Stadler, A. Org. React. 2004, 63, 1. (doi: 10.1002/0471264180.or063.01)
- ↑ Hu, E. H.; Sidler, D. R.; Dolling, U.-H. J. Org. Chem. 1998, 63, 3453-3457.
- ↑ Wipf, P.; Cunningham, A. Tetrahedron Lett. 1995, 36, 7819-7822.
- ↑ Kappe, C. O. Bioorg. Med. Chem. Lett. 2000, 10, 49-51.
- ↑ Rovnyak, G. C.; Atwal, K. S.; Hedberg, A.; Kimball, S. D.; Moreland, S.; Gougoutas, J. Z.; O'Reilly, B. C.; Schwartz, J.; Malley, M. F. J. Med. Chem. 1992, 35, 3254-3263.
- ↑ Folkers, K.; Johnson, T. B. J. Am. Chem. Soc. 1933, 55, 3784-3791.
- ↑ Sweet, F.; Fissekis, J. D. J. Am. Chem. Soc. 1973, 95, 7841-8749.
- ↑ Folkers, K.; Harwood, H. J.; Johnson, T. B. J. Am. Chem. Soc. 1932, 54, 3751-3758.
- ↑ Kappe, C.O. J. Org. Chem. 1997, 62, 7201-7204.
- ↑ O'Reilly, B. C.; Atwal, K. S. Heterocycles 1987, 26, 1185-1188 & 1189-1192.
- ↑ Atul Kumar and Ram A. Muarya Tetrahedron Letters 48, 2007, 4569-4571 doi 10.1016/j.tetlet.2007.04.130
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.