- Trifluoruro de boro
-
Trifluoruro de boro
Nombre (IUPAC) sistemático Trifluoroborano, triflúorboro General Fórmula semidesarrollada BF3 Fórmula molecular n/d Identificadores Número CAS 7637-07-2 Propiedades físicas Estado de agregación gaseoso Apariencia gas incoloro Densidad 2178 kg/m3; 2,178 g/cm3 Masa molar 67,82 g/mol Punto de fusión 146,4 K (-126,75 °C) Punto de ebullición 172,9 K (-100,25 °C) Propiedades químicas Solubilidad en agua muy soluble, benceno, tolueno, hexano, cloroformo y diclorometano Peligrosidad NFPA 704 Frases R 14, 26, 35 Frases S 1/2, 9, 26, 28, 36/37/39, 45 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl trifluoruro de boro es el compuesto químico con la fórmula BF3. Este gas incoloro tóxico pungente forma humos blancos en el aire húmedo. Es un ácido de Lewis muy útil, y un bloque de construcción versátil para los demás compuestos de boro.
Contenido
Estructura y enlace
A diferencia de los trihalogenuros de aluminio, los trihalogenuros de boro son todos monoméricos. Sufren dimerización rápida reversible, como lo indica la alta velocidad de las reacciones de intercambio de halógeno:
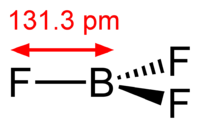
- BF3 + geometría de una molécula de BF3 está descrita como trigonal plana. La simetría D3h es coherente con la predicción de la teoría RPECV. Aunque muestra tres enlaces covalentes polares, la molécula no tiene momento dipolar neto en virtud a su alta simetría. Aunque es isoelectrónico con el anión carbonato, el BF3 suele ser referido como "deficiente en electrones", una descripción que está reforzada por su alta reactividad exotérmica hacia las bases de Lewis.
En los trihalogenuros de boro, BX3, la longitud de los enlaces B-F (1,30 Å) es más corto de lo que se esperaría para los enlaces simples,[1] y este acortamiento puede indicar un enlace π B-X más fuerte en el fluoruro. Una explicación fácil involucra el traslape de un orbital p en el átomo de boro, con la combinación enfasada de los tres orbitales p similares de los átomos de flúor, lo que está permitido por la simetría.[1]
Síntesis
El BF3 es fabricado por la reacción de los óxidos de boro con el fluoruro de hidrógeno:
- B2O3 + 6 HF → 2 BF3 + 3 H2O
Típicamente, el HF es producido in situ a partir de ácido sulfúrico y fluorita (CaF2).[2]
A escala de laboratorio, el BF3 es producido por la descomposición térmica de sales de diazonio:[3]
- PhN2BF4 → PhF + BF3 + N2
Acidez de Lewis y reacciones relacionadas
El trifluoruro de boro es un ácido de Lewis versátil que forma aductos con bases de Lewis tales como el anión fluoruro y los éteres:
- CsF + BF3 → CsBF4
- O(C2H5)2 + BF3 → BF3O(C2H5)2
Las sales tetrafluoroborato son empleadas comúnmente como anión no coordinante. El aducto con el éter dietílico, (BF3·O(Et)2, es un líquito de manejo convenito y, consecuentemente, se le encuentra ampliamente como una fuente de laboratorio de BF3. Otro aducto común es el aducto con el sulfuro de dimetilo (BF3·S(Me)2).
Acidez de Lewis comparativa
Los tres trihalogenuros de boro ligeros, BX3 (X = F, Cl, Br) forman aductos estables con bases de Lewis comunes. Su acidez relativa puede ser evaluada en términos de la exotermicidad relativa de las reacciones de formación del aducto. Tales mediciones han revelado la siguiente secuencia para la acidez de Lewis:
- BF3< BCl3< BBr3 (ácido de Lewis más fuerte)
Esta tendencia es comúnmente atribuida al grado de enlace π en el trihalogenuro de boro planar, que se perdería con la piramidalización del la molécula de BX3,[4] que sigue la siguiente tendencia:
- BF3 > BCl3 > BBr3 (más fácilmente piramidable)
Sin embargo, el criterio para evaluar la fuerza relativa del enlace π no está claro.[1]
Una de las sugerencias es que el átomo de flúor es pequeño comparado con el átomo de yodo, el par electrónico libre en el orbital p del flúor es fácilmente donado en traslape con el orbital p vacío del boro, debido a la similitud de tamaño y simetría. Como resultado, la retrodonación del flúor es mayor que la del yodo.En una explicación alternativa, la baja acidez de Lewis del BF3 es atribuida a la debilidad relativa del enlace en los aductos F3B-L.[5] [6]
Hidrólisis
El trifluoruro de boro reacciona con el agua para producir ácido bórico y ácido fluorobórico. La reacción comienza con la formación del aducto acuo, H2O-BF3, que luego pierde HF para producir ácido fluorobórico con trifluoruro de boro.
- 4 BF3 + 3 H2O → 3 HBF4 + B(OH)3
Los trihaluros superiores no sufren reacciones análogas, posiblemente debido a la menor estabilidad de los iones tetraédricos BX4- (X = Cl, Br). Debido a la alta acidez del ácido fluorobórico, el anión fluoroborato puede ser usado para aislar cationes particularmente electrofílicos, como los iones diazonio, que de otro modo son difíciles de aislar como sólidos.
Manejo
El trifluoruro de boro es corrosivo. Los metales aptos para equipo de manejo de trifluoruro de boro incluyen al acero inoxidable, monel, y hastelloy. En presencia de humedad, corroe al acero, incluyendo al acero inoxidable. Reacciona con poliamidas. El politetrafluoroetileno, policlorotrifluoroetileno, fluoruro de polivinilideno y polipropileno muestran resistencia satisfactoria. La grasa usada en el equipamiento debería ser basada en fluorocarbono, pues el trifluoruro de boro reacciona con la grasa basada en hidrocarburos.[7]
Usos
- aplicado como dopante en implantación de iones
- dopante de tipo p para silicio de crecimiento epitaxial
- iniciador de reacciones de polimerización de compuestos insaturados. Ejemplos: poliéteres
- como catalizador en algunas reacciones de isomerización, alquilación, esterificación, condensación, adición aldólica de Mukaiyama, y otras reacciones.
- usado en detectores sensibles de neutrones en cámaras de ionización y en dispositivos para monitorizar los niveles de radiación en la atmósfera de la tierra.
- en fumigación
- como un fluyente para soldadura de magnesio
- para preparar diborano
Referencias
- ↑ a b c Greenwood, N. N.; A. Earnshaw (1997). Chemistry of the Elements, 2nd Edition, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Flood, D. T.. "Fluorobenzene". Org. Synth.; Coll. Vol. 2: 295.
- ↑ Cotton, F. A.; Wilkinson, G.; Murillo, C. A.; Bochmann, M. (1999). Advanced Inorganic Chemistry (6th Edn.) New York: Wiley-Interscience. ISBN 0-471-19957-5.
- ↑ Group V Chalcogenide Complexes of Boron Trihalides Boorman, P. M.; Potts, D. Canadian. Journal of Chemistry (Rev. can. chim.) volume 52, (1974) pp 2016-2020
- ↑ T. Brinck, J. S. Murray and P. Politzer (1993). «A computational analysis of the bonding in boron trifluoride and boron trichloride and their complexes with ammonia». Inorg. Chem. 32 (12): pp. 2622–2625. doi:.
- ↑ «Boron trifluoride». Gas Encyclopedia. Air Liquide.
Enlaces externos
Categorías:- Ácidos
- Compuestos de boro
- Fluoruros
- BF3 + geometría de una molécula de BF3 está descrita como trigonal plana. La simetría D3h es coherente con la predicción de la teoría RPECV. Aunque muestra tres enlaces covalentes polares, la molécula no tiene momento dipolar neto en virtud a su alta simetría. Aunque es isoelectrónico con el anión carbonato, el BF3 suele ser referido como "deficiente en electrones", una descripción que está reforzada por su alta reactividad exotérmica hacia las bases de Lewis.
Wikimedia foundation. 2010.