- Protonterapia
-
La protonterapia, terapia de protones o terapia con protones es un tipo de radioterapia externa (RTE) con partículas subatómicas desarrollada a través de la orientación de un haz de protones hacia el tejido afectado. La principal ventaja de la terapia protónica, comparada con otras formas de radioterapia externa, es la localización precisa de la dosis de radiación, evitando efectos secundarios en tejidos circundantes al area afectada.[1]
 Panel de control del sincrociclotron en el centro de terapia protonica de Orsay, en Francia.
Panel de control del sincrociclotron en el centro de terapia protonica de Orsay, en Francia.
 En un plan de tratamiento común para terapia protónica la linea roja representando la propagación del máximo de Bragg corresponde a la distribución de radiación. La propagación del máximo de Bragg es la suma de diferentes picos de Bragg para pristina (lineas azules) en profundidades escalonadas. la dosis de profundidad de 10MV de haces fotónicos o rayos se expone para comparación.[2]
En un plan de tratamiento común para terapia protónica la linea roja representando la propagación del máximo de Bragg corresponde a la distribución de radiación. La propagación del máximo de Bragg es la suma de diferentes picos de Bragg para pristina (lineas azules) en profundidades escalonadas. la dosis de profundidad de 10MV de haces fotónicos o rayos se expone para comparación.[2]
Contenido
Descripción
Un acelerador lineal o ciclotrón dirige el haz de protones,[3] [4] emitido por una fuente apropiada, hacia el tumor; de esta manera se forma un campo magnético perpendicular a la trayectoria, producido por un potente electroimán, generando que las partículas se muevan en una trayectoria curva.[5] Estas partículas cargadas atacan el ADN celular, y pueden generar muerte celular o interferir en el proceso de división celular. Las células cancerígenas son mas vulnerables al ataque contra su ADN, esto porque tienen un alto nivel de división y bajo nivel de reparación de ADN dañado.
Considerando que la masa de un protón, (1,67261*10-27 Kg),[6] es relativamente mayor al de otras partículas subatómicas, los protones tienden a dispersarse un poco en zonas laterales del tejido; el haz no se amplía mucho, permanece enfocado en la forma del tumor y solo disipa una mínima dosis al tejido circundante. Todos los protones de un nivel energético determinado tienen cierto alcance de radiación; muy pocos protones penetran más allá de esta distancia.[7] Además, la dosis que llega al tejido es máxima justo a pocos milímetros del alcance de radiación de la partícula; este máximo es conocido como el pico de Bragg.[8]
Para el tratamiento de tumores más profundos, el acelerador de protones debe generar un haz con mayor energía, normalmente dada en electrovoltios (eV). Tumores próximos a la superficie corporal se tratan usando protones con menor energía. Los aceleradores usados en la terapia protónica esencialmente generan protones con energías en el rango de 70 a 250 MeV (Mega-electrovoltios: un millón de electrovoltios). A causa del ajuste de energía de los protones durante la aplicación del tratamiento, el daño celular debido al haz protónico se maximiza dentro del mismo tumor. Tejidos más próximos a la superficie corporal que el tumor reciben una radiación reducida, y por ende el daño es mucho menor. Tejidos corporales más profundos reciben pocos protones y por eso la dosis es inmensurablemente pequeña.[9]
En la mayoría de tratamientos, protones de diferente energía con máximos de Bragg a distintas profundidades son aplicados para tratar el tumor entero. Dichos máximos de Bragg se representan con líneas azules en la figura. La dosis total de radiación de protones se llama propagación del máximo de Bragg representado con una línea roja en la figura. Es importante entender que, mientras tejidos circundantes detrás o más profundos que el tumor no reciben radiación de la terapia protónica, el tejido circundante frente o superficial al tumor recibe una dosis de radiación basada en la propagación del máximo de Bragg.
Historia
En 1946 Robert R Wilson,[10] (diseñador del laboratorio ciclotronico de la universidad de Harvard, HCL[11] ), propuso por primera vez el uso de la energía protónica como un método de tratamiento efectivo. Los primeros tratamientos fueron efectuados con aceleradores de partículas construidos para investigación física, particularmente en el laboratorio de radiación de Berkeley en 1954 y en Uppsala en Suecia en 1957. En 1961, inicia una colaboración entre HCL y el hospital general Massachusetts (MGH) con el fin de ejercer la terapia protónica. Durante los próximos 41 años, este programa reforzó y expandió dicha técnica mientras se trataban a 9,116 pacientes[12] antes de que el ciclotrón fuera cerrado en 2002. El primer centro de terapia protónica en Europa occidental ha operado en el instituto Paul Scherrer (PSI) en Villigen, Suiza, desde 1984.[13] En 1990[14] fue construido el centro médico universitario Loma Linda (LLUMC) en Loma Linda. Posteriormente, el centro de terapia protónica Nororiental en el hospital general Massachussetts fue comprado online, y el programa de tratamiento HCL fue transferido a este durante 2001 y 2002.
Aplicación
Existen dos tipos de tratamiento con terapia protónica. El primero es empleado en sitios patológicos que favorecen la disipación de altas dosis de radiación, por ejemplo dosis escaladas. En algunos casos la dosis escalada ha logrado una probabilidad de “cura” (control local) más alta que la radioterapia convencional.[15] Estos casos incluyen entre otros el melanoma uveal, tumores paraespinales, cerebrales y otros sarcomas, en los cuales la terapia con protones ha logrado avances significativos en la probabilidad de control local, superando a la radioterapia convencional.[16] [17] [18]
El segundo tipo de tratamiento exige una alta precisión de la terapia protónica con el fin de reducir efectos indeseados, limitando la dosis al tejido normal. En estos casos la dosis para el tumor es la misma usada en terapia convencional, y por ende no se espera un incremento en la probabilidad de cura de la enfermedad. De hecho, el énfasis de este tipo de tratamiento está en la reducción de la dosis integral al tejido normal y disminución de efectos indeseados.[19] Neoplasmas pediátricos (como meduloblastoma) y cáncer de próstata son ejemplos de casos en los cuales se emplea este tipo de tratamiento. En el caso de tratamientos pediátricos existe evidencia clínica sobre la ventaja del uso de terapia protónica con reducida radiación emitida a los tejidos sanos en crecimiento y desarrollo,[20] lo cual reduce el daño a largo plazo en el niño sobreviviente.[21] [22]
En el caso de cáncer de próstata este tema no es claro. Algunos estudios publicados encuentran una reducción del daño rectal y genito-urinario a largo plazo cuando su tratamiento incluye protones y no fotones (terapia de rayos gama o rayos x). Otros estudios exponen una pequeña diferencia y limitada a casos donde la próstata está particularmente cerca a ciertas estructuras anatómicas.[23] [24] El mejoramiento relativamente menor podría ser consecuencia de la posición inconsistente del paciente y del movimiento orgánico interno durante el tratamiento, lo cual contrarresta el avance logrado con el aumento de precisión.[25] [26] [27] Una fuente propone que errores del 20% en la dosis pueden ser consecuencia de fallas de 2,5 mm en el movimiento, y otras fuentes afirman que el movimiento de la próstata ocurre entre 5 y 10 mm.
Sin embargo, el número de casos de cáncer de próstata diagnosticados cada año supera el diagnostico logrado para otras enfermedades, lo cual ha generado un enfoque de la mayor parte de dichos tratamientos al cáncer de próstata. Por ejemplo algunos hospitales destinan el 65%[28] y 50%[29] de su capacidad de terapia protónica a cáncer de próstata, mientras que otros destinan solo el 7.1 %.[30]
Algunas cifras exponen que en el año 2003 cerca del 26% de los tratamientos con terapia protónica en el mundo fueron destinados para cáncer de próstata.[31] La terapia protónica para tumores oculares es un caso especial que solo requiere una baja energía (cerca de 70MeV). Debido a este requerimiento de baja energía algunos centros de terapia con partículas solo tratan tumores oculares.[32] La terapia protónica o terapia Hadron del tejido próximo al ojo exige métodos sofisticados para calcular la alineación ocular que puede variar significativamente con la posición de verificación del paciente,[33] la cual debe asegurar que el tejido sensible como el nervio óptico sea protegido de la radiación con el fin de preservar la visión del paciente.
Comparacion con otros tratamientos
El tema sobre el tiempo, necesidad y aplicación de esta tecnología es polémico.[34] [35] [36]
Radioterapia con Rayos X
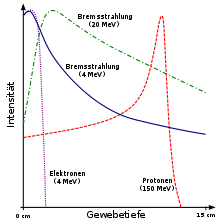
La figura presentada a la derecha de la página muestra como el haz de rayos x en el marco izquierdo y el haz de protones en el marco derecho a diferentes energías penetra el tejido humano. Un tumor de proporción gruesa es cubierto por propagaciones del máximo de Bragg representado como la distribución de líneas rojas en la figura. La propagación del máximo de Bragg es una traslapacion de diferentes máximos de prístina (líneas azules) en profundidades escalonadas.
La terapia de rayos x podría describirse como una con más “potencial de conservación de la piel” que la terapia con protones: la radiación de rayos x en la piel y algunas zonas más profundas es más baja que la radiación llevada a cabo en la terapia protónica. Un estudio reveló que la dispersión pasiva del campo protónico tiene una mayor penetración dosificadora en la piel (aproximadamente 75%) comparado con el haz fotonico a megavoltajes terapéuticos (aproximadamente 60%[37] ). La dosis de radiación con rayos x disminuye gradualmente, mientras tejidos corporales más profundos que el tumor no reciben radiación durante la terapia protónica. Además, la terapia con rayos x causa menos daño a la piel y la superficie tisular, y la terapia con protones causa menos daño a tejidos circundantes al blanco.[38]
Cirugía
La decisión de usar cirugía o terapia protónica (o de hecho cualquier clase de radioterapia) se basa en el tipo, estado y localización del tumor. En algunos casos la cirugía es prioritaria (ejemplo: melanoma cutáneo), en otros casos es conveniente usar radiación (ejemplo: condrosarcoma craneal) y otros casos ambos son tratamientos a considerar (ejemplo: cáncer de próstata). En algunos casos, se usan conjuntamente (ejemplo: cáncer rectal o estado temprano de cáncer de mama). El beneficio de la radioterapia externa protónica yace en la diferencia dosimétrica con respecto a la radioterapia externa con rayos x y braquiterapia.[39]
Efectos y riesgos
La terapia protónica es un tipo de radioterapia externa, y comparte riesgos y efectos con otras formas de radioterapia. La terapia protónica ha sido usada por casi 40 años, y es un tratamiento de avance tecnológico. Sin embargo, con todo el conocimiento medico, el entendimiento de la interacción de la radiación (protón, rayos x, etc.) con el tumor y el tejido normal aun no es perfecto.[40] [41]
Centros de tratamiento
Hasta abril de 2010 se calculó la existencia de un total de 29 centros de terapia protónica en Canadá, China, Inglaterra, Francia, Alemania, Italia, Japón, Corea, Rusia, Sur África, Suecia, Suiza y Estados Unidos[42] y más de 67000 pacientes han sido tratados. Un obstáculo para el uso universal de protones en el tratamiento de cáncer es el tamaño y costo del ciclotrón o sincrociclotrón necesario como acelerador de las partículas subatómicas. Diversos equipos industriales trabajan en el desarrollo de un ciclotrón o sincrociclotrón de menor tamaño para tratamiento de pacientes con terapia protónica.[43]
Referencias
- ↑ Gonzales, A. Avances en la terapia protónica. Revista cubana de fisica, Vol 24. No. 2 (2007). P 176.
- ↑ "Proton beam therapy" W P Levin, H Kooy, J S Loeffler and T F DeLaney British Journal of Cancer (2005) 93, 849–854 [1]
- ↑ O. Jakel: State of the art in hadron therapy. AIP Conference Proceedings, vol. 958, no.1, 2007, pp. 70-77
- ↑ Zap! You're not dead." Economist, 8 September 2007. 384 (8545):13-14
- ↑ Gonzales, A. Avances en la terapia protónica. Revista cubana de fisica, Vol 24. No. 2 (2007). P 175,176
- ↑ Serway y Jewet. Fisica II. Texto basado en calculo. 3ra edición. Ed. Thomson. PP 10
- ↑ Metz, James (2006-07-31). "Differences Between Protons and X-rays". The Abramson Cancer Center of the University of Pennsylvania. http://www.oncolink.org/treatment/article.cfm?c=9&s=70&id=210. Retrieved 2008-02-04. "the beam then stops, resulting in virtually no radiation to the tissue beyond the target- or no "exit dose""
- ↑ Camphausen KA, Lawrence RC. "Principles of Radiation Therapy" in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management: A Multidisciplinary Approach. 11 ed. 2008.
- ↑ Metz, James (2006-07-31). "Differences Between Protons and X-rays". The Abramson Cancer Center of the University of Pennsylvania. http://www.oncolink.org/treatment/article.cfm?c=9&s=70&id=210. Retrieved 2008-02-04. "the beam then stops, resulting in virtually no radiation to the tissue beyond the target- or no "exit dose""
- ↑ Radiological Use of Fast Protons", R. R. Wilson, Radiology, 47:487-491 (1946)
- ↑ Richard Wilson, "A Brief History of the Harvard University Cyclotrons", Harvard University Press, 2004, pp 9
- ↑ PTCOG: Particle Therapy Co-Operative Group". Ptcog.web.psi.ch. http://ptcog.web.psi.ch/. Retrieved 2009-09-03.
- ↑ PTCOG: Particle Therapy Co-Operative Group". Ptcog.web.psi.ch. http://ptcog.web.psi.ch/. Retrieved 2009-09-03.
- ↑ PTCOG: Particle Therapy Co-Operative Group". Ptcog.web.psi.ch. http://ptcog.web.psi.ch/. Retrieved 2009-09-03.
- ↑ R. P. Levy et al,The current status and future directions of heavy charged particle therapy in medicine, AIP Journal, March 2009
- ↑ E. B. Hug et al: Proton radiation therapy for chordomas and chondrosarcomas of the skull base, J. Neurosurgery 91, 432-439 (1999)
- ↑ E. Gragoudas et al, Evidence-based estimates of outcomes in patients treated for intraocular melenoma", Arch. Ophthalmol.120, 1665-1671 (2002)
- ↑ J. E. Munzenrider, N. J. Liebsch, Proton radiotherapy for tumors of the skull base, Strahnlenther. Onkol. 175, 57-63 (1999)
- ↑ R. P. Levy et al,The current status and future directions of heavy charged particle therapy in medicine, AIP Journal, March 2009
- ↑ Gonzales, A. Avances en la terapia protónica. Revista cubana de fisica, Vol 24. No. 2 (2007). P 176.
- ↑ W. H. St. Clair et al, Advantage of protons compared to conventional X-ray or IMRT in the treatment of a pediatric patient with medulloblastoma, Int. J. Radiat. Oncol. Biol. Phys.58, 727-734 (2004)
- ↑ D.g. Kirsch and N. J. Tarbell, Conformal radiaiton therapy for chilfhood CNS tumors, The Oncologist 9(4), 442-450 (2004)
- ↑ J. D. Slater et al, Proton therapy for prostate cancer; the initial Loma Linda University experience, Int. J. Radiat. Oncol. Biol. Phys 59, 348-352 (2004)
- ↑ A. L. Zietman et al, Comparisons of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial, J. A. M. A. 294(10, 1233-1239 (2005)
- ↑ A. L. Zietman et al, Comparisons of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial, J. A. M. A. 294(10, 1233-1239 (2005)
- ↑ R. deCrevoisier et al, "Increased risk of biochemical and local failure in patients with distended rectum on the planning CT for prostate cancer radiotherapy," Int. J. Radiat. Oncol. Biol. Phys. 62(4) 965-973 (2005)
- ↑ Lambert et al. "Intrafractional motion during proton beam scanning" Phys. Med. Biol. 50 4853-4862 2005
- ↑ Dyk, Jacob, Van (1999). The modern technology of radiation oncology: A Compendium for Medical Physicists and Radiation Oncologists. p. 826: Medical Physics Publishing Corporation. p. 1072. ISBN 0-944838-38-3, 9780944838389. http://books.google.com/books?id=U5JrAAAAMAAJ&. "Proton Patient Summary - Inception Through December 1998...Prostate...2591 64.3%"
- ↑ "The Promise of Proton-Beam Therapy". U.S. News and World Report. 2008-04-16. http://health.usnews.com/articles/health/cancer/2008/04/16/the-promise-of-proton-beam-therapy.html?PageNr=1. Retrieved 2008-02-20
- ↑ Francis H. Burr Proton Therapy Center". http://ptcog.web.psi.ch/PTCOG47/presentations/4_Meeting_Thursday/TDelaneyupdate.pdf.
- ↑ J. Sisterson, Ion beam therapy in 2004, Nuclear Instruments and Methods in Physics Research B 241 713-716 (2005)
- ↑ PTCOG: Particle Therapy Co-Operative Group". Ptcog.web.psi.ch. http://ptcog.web.psi.ch/. Retrieved 2009-09-03.
- ↑ Boris Peter Selby et al., "Pose estimation of eyes for particle beam treatment of tumors.", Bildverarbeitung für die Medizin (Medical Image Processing); Munich, 2007 pp. 368-373.
- ↑ EDITORIAL: Randomized Trials and Technology Assessment". Annals of Internal Medicine 151 (8): 583–584. 20 October 2009. http://www.annals.org/cgi/content/short/151/8/583.
- ↑ BOULTON, GUY (March 30, 2008). "High cost; of high tech; Outlay vs. benefit of expensive medical devices questioned". Milwaukee Journal Sentinel. http://www.highbeam.com/doc/1P2-15594684.html. Retrieved 2009-09-03. ""Despite that controversy, roughly a dozen proton therapy centers have been proposed throughout the country, including northern Illinois
- ↑ The $150 Million Zapper:Does every cancer patient really need proton-beam therapy?". Forbes Magazine. March 16, 2009. http://www.forbes.com/forbes/2009/0316/062_150mil_zapper.html. Retrieved 2009-09-03.
- ↑ Proton beam therapy" W P Levin, H Kooy, J S Loeffler and T F DeLaney British Journal of Cancer (2005) 93, 849–854
- ↑ Zap! You're not dead." Economist, 8 September 2007. 384 (8545):13-14
- ↑ R. P. Levy et al,The current status and future directions of heavy charged particle therapy in medicine, AIP Journal, March 2009
- ↑ Joel E. Tepper, MD, and A. William Blackstock, MD "Randomized Trials and Technology Assessment" Annals of Internal Medicine 151(8) 2009
- ↑ Federal Agency for Healthcare Research and Quality "Technical Brief: Particle Beam Radiation Therapies for Cancer" 2009
- ↑ Particle therapy facilities in operation". Particle Therapy Co-Operative Group. http://ptcog.web.psi.ch/ptcentres.html. Retrieved 2010-04-27.
- ↑ J.N.A. Matthews: "Accelerators shrink to meet growing demand for proton therapy", Physics Today, März 2009, p. 22
- Este artículo fue creado a partir de la traducción total del artículo proton therapy de la Wikipedia en inglés, concretamente de esta versión, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Lecturas Adicionales
- Greco C, Wolden S. Current status of radiotherapy with proton and light ion beams. Cancer. 2007 Apr 1;109(7):1227-38 PMID 17326046
- "Use of Protons for Radiotherapy", A.M. Koehler, Proc. of the Symposium on Pion and Proton Radiotherapy, Nat. Accelerator Lab., (1971)
- "Protons in Radiation Therapy: comparative Dose Distributions for Protons, Photons and Electrons, A.M. Koehler, W.M. Preston, Radiology, 104(1):191-195 (1972)
- "Bragg Peak Proton Radiosurgery for Arteriovenous Malformation of the Brain" R.N. Kjelberg, presented at First Int. Seminar on the Use of Proton Beams in Radiation Therapy, Moskow (1977)
- "Fractionated Proton Radiation Therapy of Cranial and Intracrainial Tumors" Austin-Seymor, M.J. Munzenrider, et al. Am.J.of Clinical Oncology 13(4):327-330 (1990)
- "Proton Radiotherapy", Hartford, Zietman, et al. in Radiotheraputic Management of Carcinoma of the Prostate, A. D'Amico and G.E. Hanks. London,UK, Arnold Publishers: 61-72 (1999)
Enlaces externos
- Proton therapy - MedlinePlus Medical Encyclopedia
- Proton Therapy
 Wikimedia Commons alberga contenido multimedia sobre Protonterapia. Commons
Wikimedia Commons alberga contenido multimedia sobre Protonterapia. Commons
Wikimedia foundation. 2010.
