- Transposición de Bamberger
-
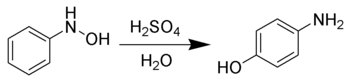
La Transposición de Bamberger es una reacción orgánica en donde se hace reaccionar N-fenilhidroxilaminas con un ácido fuerte en medio acuoso; cuando la transposición se lleva a cabo la transposición se obtienen 4-aminofenoles.[1] [2] Fue descrita por el químico alemán Eugen Bamberger (1857–1932).
Las N-fenilhidroxilaminas son comúnmente preparadas a partir de la hidroxilación oxidativa de nitrobenceno con uso de un catalizador de rodio[3] o zinc.[4]
Mecanismo
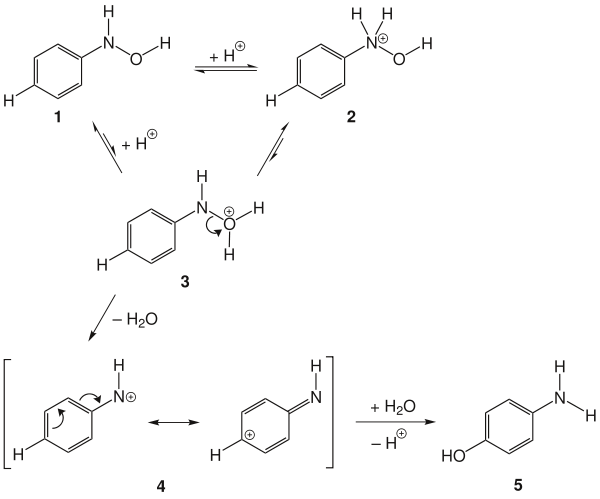
El mecanismo de la transposición de Bamberger procede a partir de la protonación de la N-fenilhidroxilamina 1. De la protonación en el nitrógeno no se obtiene producto 2. De la protonación del oxígeno 3 se puede formar el ion nitrenio por dehidratación, el cual puede entrar en resonancia con el anillo de benceno, haciendo que éste reaccione con el agua para formar el 4-aminofenol deseado 5.[5] [6]
Referencias
- ↑ Bamberger, E. (1894). «Uber das Phenylhydroxylamin». Chem. Ber. 27: pp. 1347 & 1548–1557. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k907342/f376.table.
- ↑ Harman, R. E. (1955). «Chloro-p-benzoquinone». Organic Syntheses 35: pp. 22. http://www.orgsyn.org/orgsyn/prep.asp?prep=cv4p0148. (also in the Collective Volume (1963) 4:148 (PDF)).
- ↑ Oxley, P. W.; Adger, B. M.; Sasse, M. J.; Forth, M. A. (1989). «N-Acetyl-N-phenylhydroxylamine via Catalytic Transfer Hydrogenation of Nitrobenzene using Hydrazine and Rhodium on Carbon». Organic Syntheses 67: pp. 187. http://www.orgsyn.org/orgsyn/prep.asp?prep=cv8p0016. (also in the Collective Volume (1993) 8:16 (PDF)).
- ↑ Kamm, O. (1925). «β-Phenylhydroxylamine». Organic Syntheses 4: pp. 57. http://www.orgsyn.org/orgsyn/prep.asp?prep=cv1p0445. (also in the Collective Volume (1941) 1:445 (PDF)).
- ↑ Sone, Takaaki; Hamamoto, Kazuhiro; Seiji, Yoshiyuki; Shinkai, Seiji; Manabe, Osamu (1981). «Kinetics and mechanisms of the Bamberger rearrangement. Part 4. Rearrangement of sterically hindered phenylhydroxylamines to 4-aminophenols in aqueous sulphuric acid solution». J. Chem. Soc. Perkin Trans. II: pp. 1596–1598. doi:.
- ↑ George Kohnstam, W. Andrew Petch and D. Lyn H. Williams (1984). «Kinetic substituent and isotope effects in the acid-catalysed rearrangement of N-phenylhydroxylamines. Are nitrenium lons involved?». J. Chem. Soc. Perkin Trans. II: pp. 423–427. doi:.
Véase también
- Transposición de Hofmann-Martius
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.