- Rodio
-
Rodio
Rutenio - Rodio - Paladio Co
Rh
Ir
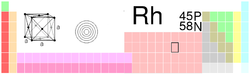
General Nombre, símbolo, número Rodio, Rh, 45 Serie química Metal de transición Grupo, periodo, bloque 9, 5, d Densidad, dureza Mohs 12450 kg/m3, 6 Apariencia Blanco plateado metálico

Propiedades atómicas Masa atómica 102,90550 u Radio medio† 135 pm Radio atómico calculado 173 pm Radio covalente 135 pm Radio de Van der Waals Sin datos Configuración electrónica [Kr]4d8 5s1 Estados de oxidación (óxido) 2, 3, 4 (anfótero) Estructura cristalina Cúbica centrada en las caras Propiedades físicas Estado de la materia Sólido (__) Punto de fusión 2237 K Punto de ebullición 3968 K Entalpía de vaporización 493 kJ/mol Entalpía de fusión 21,5 kJ/mol Presión de vapor 0,633 Pa a 2239 K Velocidad del sonido 4700 m/s a 293,15 K Información diversa Electronegatividad 2,28 (Pauling) Calor específico 242 J/(kg·K) Conductividad eléctrica 21,1 × 106 m-1·Ω-1 Conductividad térmica 150 W/(m·K) 1er potencial de ionización 719,7 kJ/mol 2° potencial de ionización 1740 kJ/mol 3er potencial de ionización 2997 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 101Rh Sintético 3,3 a ε 0,542 101Ru 102mRh Sintético ~2,9 a ε
TI2,464
0,141102Ru
103Rh 100% Rh es estable con 58 neutrones Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El rodio es un elemento químico de número atómico 45 situado en el grupo 9 de la tabla periódica de los elementos. Su símbolo es Rh. Es un metal de transición, poco abundante, del grupo del platino. Se encuentra normalmente en minas de platino y se emplea como catalizador en algunas aleaciones de platino.
Contenido
Historia
El rodio, del griego rhodos ("rosa", por el color de algunas soluciones de este metal) fue descubierto en 1803 por William Hyde Wollaston, poco después de haber descubierto el paladio.
El método seguido fue el siguiente: partiendo de mineral de platino, lo disolvió en agua regia y neutralizó con sosa cáustica. Con cloruro de amonio precipitó el platino, y con cianuro de mercurio eliminó el paladio. El resultado fue una sustancia roja que contenía sales de cloruro de rodio, de las que se puede obtener el rodio mediante reducción con gas hidrógeno.
Características principales
El rodio es un metal dúctil de color blanco plateado. No se disuelve en ácidos, ni siquiera en agua regia, aunque finamente dividido sí que se puede disolver en ésta, y también en ácido sulfúrico concentrado y en caliente, H2SO4. El rodio tiene un punto de fusión mayor que el del platino y una densidad menor. Al igual que todos los metales del grupo del platino o PGM'S (PLATINUM GROUP METALS), es un poderoso catalizador usado en combinación con el platino se usa para producir ácido nítrico a partir del amoniaco, se usa también como base reflectiva en los faros vehiculares de alta gama por su intenso brillo y su caracteristica de ser inoxidable hasta en medios ácidos. El Rodio es el metal mas importante dentro de los PGM'S, ya que por su escasez en la naturaleza alcanza precios elevados, aunque aun no se ha descubierto la totalidad de aplicaciones industriales que tiene este metal.
Sus estados de oxidación más comunes son +2, +3, 0 y –1
Utilización
Catalizador
El principal uso industrial del rodio (81% en el año 2007) es como componente de catalizadores. Presenta ventajas sobre el platino en la reducción de los dañinos óxidos de nitrógeno para obtener nitrógeno y oxígeno. Además tiene utilidad en la industria de los hidrocarburos.
Debido a su alto precio, el reciclado de catalizadores usados se ha convertido en una de las principales fuentes de obtención de este metal.
Otros usos
El rodio es un elemento muy usado en joyería. Típicamente, el oro blanco es galvanizado con una capa externa de rodio de 0.05 a 0.5 μm de espesor. Por el espesor tan reducido, los rayones en esta capa pueden permitir la oxidación y esto debilitará aún más la capa de rodio. Lo ideal sería una capa de 2.0 μm para que dure más tiempo. Una joya de oro blanco con rodio puede ser enchapada de nuevo en algunas joyerías.
También se emplea en aplicaciones para contactos eléctricos, por su baja resistencia eléctrica y alta resistencia a la corrosión. El rodio es galvanizado fácilmente para formar superficies duras, resistentes al desgaste y de brillo permanente, utilizadas tanto en contactos eléctricos estacionarios como corredizos, en espejos y reflectores, y como acabado en joyería.
Peligrosidad
Como metal puro, el rodio es completamente inerte y no representa riesgo para la salud humana. Sin embargo, los compuestos de rodio son altamente tóxicos y cancerígenos.[1]
Si se encuentra en forma de polvo, es básico mantenerlo alejado de chispas o llamas, pues tiene riesgo de explosión. Asimismo, se ha de evitar la inhalación del polvo.
Referencias externas
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del rodio.
Categorías: Elementos químicos | Materiales superconductores
Wikimedia foundation. 2010.
