- Voltámetro de Hofmann
-
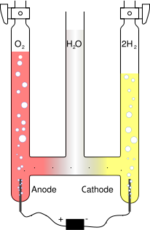
Un voltámetro de Hofmann es un aparato utilizado para realizar la electrólisis del agua. Fue inventado por August Wilhelm von Hofmann (1818-1892).[1] Consta de tres cilindros verticales unidos, por lo general de vidrio. El cilindro central está abierto en la parte superior para permitir la adición de agua y de un compuesto iónico para mejorar la conductividad, como puede ser una pequeña cantidad de ácido sulfúrico. Un electrodo de platino se coloca dentro de la parte inferior de cada uno de los otros dos cilindros, y se conectan a los terminales positivo y negativo de una fuente de electricidad. Cuando la corriente circula a través del voltámetro de Hofmann, se forma oxígeno en el ánodo e hidrógeno en el cátodo. Cada uno de los gases desplaza el agua contenida en su cilindro y se acumula en la parte superior de los dos tubos exteriores.
El término “voltámetro”
El término de voltámetro" fue acuñado por Daniell, que acortó el nombre original de Faraday de "Volta-electrómetro".[2] Los voltámetros de Hofmann ya no se utilizan como dispositivos de medición eléctrica. Sin embargo, antes de la invención del amperímetro, los voltámetros se utilizaban a menudo para medir la corriente eléctrica, ya que la corriente a través de un voltámetro con electrodos de hierro o cobre electrodeposita en el cátodo una cantidad de metal del ánodo que es directamente proporcional a la corriente total (ley de Faraday de la electrólisis). El nombre actual es "culombímetro electroquímico".
Usos
La cantidad de electricidad que ha pasado por el sistema puede determinarse pesando el cátodo. Thomas Alva Edison utilizó voltámetros como contadores de electricidad. (Un voltámetro de Hofmann no se puede utilizar para pesar la corriente eléctrica de esta manera, ya los electrodos de platino son muy inertes para el electroplateado.)
El voltámetro de Hofmann se utiliza a menudo como una demostración de los principios estequiométricos, como la razón de los volúmenes de los gases hidrógeno y oxígeno, dos a uno, por el aparato muestra la fórmula química del agua, H2O.
Referencias
- ↑ von Hofmann, A. W. Introduction to Modern Chemistry: Experimental and Theoretic; Embodying Twelve Lectures Delivered in the Royal College of Chemistry, London. Walton and Maberly, London, 1866. [1]
- ↑ Frank A. J. L. James, (1991), The correspondence of Michael Faraday, IET, ISBN 0-86341-249-1, letter 872, 9/1/1836
Wikimedia foundation. 2010.