- Hidrógeno
-
- Este artículo trata sobre un elemento químico. Para la molécula (H2), formada por dos átomos de hidrógeno, véase Dihidrógeno.
Para otros usos de este término véase Hidrógeno (desambiguación).
- ← Hidrógeno → Helio - 
1H ↑
H
↓Li Tabla completa • Tabla extendida Apariencia Incoloro Información general Nombre, símbolo, número Hidrógeno, H, 1 Serie química No metales Grupo, período, bloque 1, 1, s Configuración electrónica 1s1 Electrones por nivel 1 Propiedades atómicas Radio medio 25 pm Electronegatividad 2,2 (Pauling) Radio atómico (calc) 53 pm (Radio de Bohr) Radio covalente 37 pm Radio de van der Waals 120 pm Estado(s) de oxidación 1, -1 Óxido Anfótero 1.ª Energía de ionización 1312 kJ/mol 2.ª Energía de ionización {{{E_ionización2}}} kJ/mol 3.ª Energía de ionización {{{E_ionización3}}} kJ/mol Propiedades físicas Estado ordinario Gas Densidad 0,089 9 kg/m3 Punto de fusión 14,025 K Punto de ebullición 20,268 K Punto de inflamabilidad 255 K Entalpía de vaporización 0,44936 kJ/mol Entalpía de fusión 0,05868 kJ/mol Presión de vapor 209 Pa a 23 K Temperatura crítica 23,97 K Presión crítica 1,293·106 Pa Volumen molar 22,42×10-3 m3/mol Varios Estructura cristalina Hexagonal N° CAS 1333-74-0 N° EINECS 215-605-7 Calor específico 1,4304·104 J/(K·kg) Conductividad eléctrica - S/m Conductividad térmica 0,1815 W/(K·m) Velocidad del sonido 1270 m/s a 293.15 K (20 °C) Isótopos más estables iso AN Periodo MD Ed PD MeV 1H 99,985 % Estable con 0 neutrones 2H 0,015 % Estable con 1 neutrón 3H trazas 12,33 años β 0,019 3He Nota: unidades según el SI y en CNPT, salvo indicación contraria. El hidrógeno es un elemento químico representado por el símbolo H y con un número atómico de 1. En condiciones normales de presión y temperatura, es un gas diatómico (H2) incoloro, inodoro, insípido, no metálico y altamente inflamable. Con una masa atómica de 1,00794(7) u, el hidrógeno es el elemento químico más ligero y es, también, el elemento más abundante, constituyendo aproximadamente el 75% de la materia visible del universo.[1]
En su ciclo principal, las estrellas están compuestas por hidrógeno en estado de plasma. El hidrógeno elemental es muy escaso en la Tierra y es producido industrialmente a partir de hidrocarburos como, por ejemplo, el metano. La mayor parte del hidrógeno elemental se obtiene "in situ", es decir, en el lugar y en el momento en el que se necesita. El hidrógeno puede obtenerse a partir del agua por un proceso de electrólisis, pero resulta un método mucho más caro que la obtención a partir del gas natural.
Sus principales aplicaciones industriales son el refinado de combustibles fósiles (por ejemplo, el hidrocracking) y la producción de amoníaco (usado principalmente para fertilizantes).
El isótopo del hidrógeno más común en la naturaleza, conocido como protio (término muy poco usado), tiene un solo protón y ningún neutrón. En los compuestos iónicos, el hidrógeno puede adquirir carga positiva (convirtiéndose en un catión llamado hidrón, H+, compuesto únicamente por un protón, a veces acompañado de algún neutrón); o carga negativa (convirtiéndose en un anión conocido como hidruro, H-).
El hidrógeno puede formar compuestos con la mayoría de los elementos y está presente en el agua y en la mayoría de los compuestos orgánicos. Desempeña un papel particularmente importante en la química ácido - base, en la que muchas reacciones conllevan el intercambio de protones (iones hidrógeno, H+) entre moléculas solubles. Puesto que es el único átomo neutro para el cual la ecuación de Schrödinger puede ser resuelta analíticamente, el estudio de la energía y del enlace del átomo de hidrógeno ha sido fundamental para el desarrollo de la mecánica cuántica.
Contenido
Nomenclatura
Hidrógeno, del latín "hydrogenium", y éste del griego antiguo ὕδωρ (hydor): "agua" y γένος-ου(genos): "generador". "generador de agua"
La palabra hidrógeno puede referirse tanto al átomo de hidrógeno (descrito en este artículo), como a la molécula diatómica (H2) que se encuentra a nivel de trazas en la atmósfera terrestre. Los químicos tienden a referirse a esta molécula como dihidrógeno,[2] molécula de hidrógeno, o hidrógeno diatómico, para distinguirla del átomo del elemento, que no existe de forma aislada en las condiciones ordinarias.
Historia
Descubrimiento del hidrógeno
El hidrógeno diatómico gaseoso, H2, fue formalmente descrito por primera vez por T. Von Hohenheim (más conocido como Paracelso, 1493-1541) que lo obtuvo artificialmente mezclando metales con ácidos fuertes. Paracelso no era consciente de que el gas inflamable generado en estas reacciones químicas estaba compuesto por un nuevo elemento químico. En 1671, Robert Boyle redescubrió y describió la reacción que se producía entre limaduras de hierro y ácidos diluidos, y que generaba hidrógeno gaseoso.[3]
En 1766, Henry Cavendish fue el primero en reconocer el hidrógeno gaseoso como una sustancia discreta, identificando el gas producido en la reacción metal - ácido como "aire inflamable" y descubriendo que la combustión del gas generaba agua. Cavendish tropezó con el hidrógeno cuando experimentaba con ácidos y mercurio. Aunque asumió erróneamente que el hidrógeno era un componente liberado por el mercurio y no por el ácido, fue capaz de describir con precisión varias propiedades fundamentales del hidrógeno. Tradicionalmente, se considera a Cavendish el descubridor de este elemento.
En 1783, Antoine Lavoisier dio al elemento el nombre de hidrógeno (en francés Hydrogène, del griego ὕδωρ, ὕδᾰτος, "agua" y γένος-ου, "generador") cuando comprobó (junto a Laplace) el descubrimiento de Cavendish.
En el artículo teoría del flogisto se narra un poco más acerca de esta historia.
Papel del hidrógeno en la Teoría Cuántica
Gracias a su estructura atómica relativamente simple, consistente en un solo protón y un solo electrón para el isótopo más abundante (protio), el átomo de hidrógeno posee un espectro de absorción que pudo ser explicado cuantitativamente lo que supuso un punto central del modelo atómico de Bohr que sirvió como un hito en el desarrollo la Teoría de la Estructura Atómica. Además, la consiguiente simplicidad de la molécula de hidrógeno diatómico y el correspondiente catión dihidrógeno, H2+, permitió una comprensión más completa de la naturaleza del enlace químico, que continuó poco después con el tratamiento mecano - cuántico del átomo de hidrógeno, que había sido desarrollado a mediados de la década de 1920 por Erwin Schrödinger y Werner Heisenberg.
Uno de los primeros efectos cuánticos que fue explícitamente advertido (pero no entendido en ese momento) fue una observación de Maxwell en la que estaba involucrado el hidrógeno, medio siglo antes de que se estableciera completamente la Teoría Mecano - Cuántica. Maxwell observó que el calor específico del H2, inexplicablemente, se desviaba del correspondiente a un gas diatómico por debajo de la temperatura ambiente y comenzaba a parecerse cada vez más al correspondiente a un gas monoátomico a temperaturas muy bajas. De acuerdo con la Teoría Cuántica, este comportamiento resulta del espaciamiento de los niveles energéticos rotacionales (cuantizados), que se encuentran particularmente separados en el H2 debido a su pequeña masa. Estos niveles tan separados impiden el reparto equitativo de la energía calorífica para generar movimiento rotacional en el hidrógeno a bajas temperaturas. Los gases diatómicos compuestos de átomos pesados no poseen niveles energéticos rotacionales tan separados y, por tanto, no presentan el mismo efecto que el hidrógeno.[4]
Sólo hay un elemento en la tabla periódica que no pertenezca a ningún grupo en particular: el hidrógeno. Este elemento tiene una química singular. Además sus tres isótopos difieren tanto en sus masas moleculares que las propiedades físicas y químicas son sensiblemente diferentes.
Abundancia
El hidrógeno es el elemento más abundante del universo, suponiendo más del 75% en masa y más del 90% en número de átomos.[5] Este elemento se encuentra en abundancia en las estrellas y los planetas gaseosos gigantes. Las nubes moleculares de H2 están asociadas a la formación de las estrellas. El hidrógeno también juega un papel fundamental como combustible de las estrellas por medio de las reacciones de fusión nuclear entre núcleos de hidrógeno.
En el universo, el hidrógeno se encuentra principalmente en su forma atómica y en estado de plasma, cuyas propiedades son bastante diferentes a las del hidrógeno molecular. Como plasma, el electrón y el protón del hidrógeno no se encuentran ligados, por lo que presenta una alta conductividad eléctrica y una gran emisividad (origen de la luz emitida por el Sol y otras estrellas). Las partículas cargadas están fuertemente influenciadas por los campos eléctricos y magnéticos. Por ejemplo, en los vientos solares las partículas interaccionan con la magnetosfera terrestre generando corrientes de Birkeland y el fenómeno de las auroras.
Bajo condiciones ordinarias en la Tierra, el hidrógeno existe como gas diatómico, H2. Sin embargo, el hidrógeno gaseoso es extremadamente poco abundante en la atmósfera de la Tierra (1 ppm en volumen), debido a su pequeña masa que le permite escapar al influjo de la gravedad terrestre más fácilmente que otros gases más pesados. Aunque los átomos de hidrógeno y las moléculas diatómicas de hidrógeno abundan en el espacio interestelar, son difíciles de generar, concentrar y purificar en la Tierra. El hidrógeno es el decimoquinto elemento más abundante en la superficie terrestre[6] La mayor parte del hidrógeno terrestre se encuentra formando parte de compuestos químicos tales como los hidrocarburos o el agua.[7] El hidrógeno gaseoso es producido por algunas bacterias y algas, y es un componente natural de las flatulencias. El metano es una fuente de enorme importancia para la obtención del hidrógeno.
El átomo de hidrógeno
Niveles energéticos electrónicos
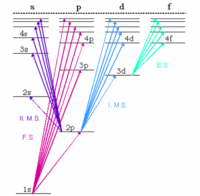
El nivel energético del estado fundamental electrónico de un átomo de hidrógeno es -13,6 eV, que equivale a un fotón ultravioleta de, aproximadamente, 92 nm de longitud de onda.
Los niveles energéticos del hidrógeno pueden calcularse con bastante precisión empleando el modelo atómico de Bohr, que considera que el electrón orbita alrededor del protón de forma análoga a la orbita terrestre alrededor del Sol. Sin embargo, la fuerza electromagnética hace que el protón y el electrón se atraigan, de igual modo que los planetas y otros cuerpos celestes se atraen por la fuerza gravitatoria. Debido al carácter discreto (cuantizado) del momento angular postulado en los inicios de la Mecánica Cuántica por Bohr, el electrón en el modelo de Bohr sólo puede orbitar a ciertas distancias permitidas alrededor del protón y, por extensión, con ciertos valores de energía permitidos. Una descripción más precisa del átomo de hidrógeno viene dada mediante un tratamiento puramente mecano - cuántico que emplea la ecuación de onda de Schrödinger o la formulación equivalente de las integrales de camino de Feynman para calcular la densidad de probabilidad del electrón. El tratamiento del electrón a través de la hipótesis de De Broglie (dualidad onda - partícula) reproduce resultados químicos (tales como la configuración del átomo de hidrógeno) de manera más natural que el modelo de partículas de Bohr, aunque la energía y los resultados espectrales son los mismos. Si en la construcción del modelo se emplea la masa reducida del núcleo y del electrón (como se haría en el problema de dos cuerpos en Mecánica Clásica), se obtiene una mejor formulación para los espectros del hidrógeno, y los desplazamientos espectrales correctos para el deuterio y el tritio. Pequeños ajustes en los niveles energéticos del átomo de hidrógeno, que corresponden a efectos espectrales reales, pueden determinarse usando la Teoría Mecano - Cuántica completa, que corrige los efectos de la Relatividad Especial (ver ecuación de Dirac), y computando los efectos cuánticos originados por la producción de partículas virtuales en el vacío y como resultado de los campos eléctricos (ver Electrodinámica Cuántica).
En el hidrógeno gaseoso, el nivel energético del estado electrónico fundamental está dividido a su vez en otros niveles de estructura hiperfina, originados por el efecto de las interacciones magnéticas producidas entre los espines del electrón y del protón. La energía del átomo cuando los espines del protón y del electrón están alineados es superior que cuando los espines no lo están. La transición entre esos dos estados puede tener lugar mediante la emisión de un fotón a través de una transición de dipolo magnético. Los radiotelescopios pueden detectar la radiación producida en este proceso, lo que sirve para crear mapas de distribución del hidrógeno en la galaxia.
Isótopos
El hidrógeno posee tres isótopos naturales que se denotan como 1H, 2H y 3H. Otros isótopos altamente inestables (del 4H al 7H) han sido sintetizados en laboratorio, pero nunca observados en la naturaleza.[8] [9]
- 1H, conocido como protio, es el isótopo más común del hidrógeno con una abundancia de más del 99,98%. Debido a que el núcleo de este isótopo está formado por un solo protón se le ha bautizado como protio, nombre que a pesar de ser muy descriptivo, es poco usado.
- 2H, el otro isótopo estable del hidrógeno, es conocido como deuterio y su núcleo contiene un protón y un neutrón. El deuterio representa el 0,0026% o el 0,0184% (según sea en fracción molar o fracción atómica) del hidrógeno presente en la Tierra, encontrándose las menores concentraciones en el hidrógeno gaseoso, y las mayores (0,015% o 150 ppm) en aguas oceánicas. El deuterio no es radiactivo, y no representa un riesgo significativo de toxicidad. El agua enriquecida en moléculas que incluyen deuterio en lugar de hidrógeno 1H (protio), se denomina agua pesada. El deuterio y sus compuestos se emplean en marcado no radiactivo en experimentos y también en disolventes usados en espectroscopia 1H - RMN. El agua pesada se utiliza como moderador de neutrones y refrigerante en reactores nucleares. El deuterio es también un potencial combustible para la fusión nuclear con fines comerciales.
- 3H se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivo, desintegrándose en 32He+ a través de una emisión beta. Posee un periodo de semidesintegración de 12,33 años.[7] Pequeñas cantidades de tritio se encuentran en la naturaleza por efecto de la interacción de los rayos cósmicos con los gases atmosféricos. También ha sido liberado tritio por la realización de pruebas de armamento nuclear. El tritio se usa en reacciones de fusión nuclear, como trazador en Geoquímica Isotópica, y en dispositivos luminosos auto - alimentados. Antes era común emplear el tritio como radiomarcador en experimentos químicos y biológicos, pero actualmente se usa menos.
El hidrógeno es el único elemento que posee diferentes nombres comunes para cada uno de sus isótopos (naturales). Durante los inicios de los estudios sobre la radiactividad, a algunos isótopos radiactivos pesados les fueron asignados nombres, pero ninguno de ellos se sigue usando. Los símbolos D y T (en lugar de 2H y 3H) se usan a veces para referirse al deuterio y al tritio, pero el símbolo P corresponde al fósforo y, por tanto, no puede usarse para representar al protio. La IUPAC declara que aunque el uso de estos símbolos sea común, no es lo aconsejado.
Formas elementales moleculares
Existen dos tipos distintos de moléculas diatómicas de hidrógeno que difieren en la relación entre los espines de sus núcleos:[10]
- Orto - hidrógeno: los espines de los dos protones se encuentran paralelos y conforman un estado triplete.
- Para - hidrógeno: los espines de los dos protones se encuentran antiparalelos y conforman un estado singlete.
En condiciones normales de presión y temperatura el hidrógeno gaseoso contiene aproximadamente un 25% de la forma para y un 75% de la forma orto, también conocida como "forma normal".[11] La relación del equilibrio entre orto - hidrógeno y para - hidrógeno depende de la temperatura, pero puesto que la forma orto es un estado excitado, y por tanto posee una energía superior, es inestable y no puede ser purificada. A temperaturas muy bajas, el estado de equilibrio está compuesto casi exclusivamente por la forma para. Las propiedades físicas del para - hidrógeno puro difieren ligeramente de las de la forma normal (orto).[12] La distinción entre formas orto / para también se presenta en otras moléculas o grupos funcionales que contienen hidrógeno, tales como el agua o el metileno.
La interconversión no catalizada entre el para - hidrógeno y el orto - hidrógeno se incrementa al aumentar la temperatura; por esta razón, el H2 condensado rápidamente contiene grandes cantidades de la forma orto que pasa a la forma para lentamente.[13] La relación orto / para en el H2 condensado es algo importante a tener en cuenta para la preparación y el almacenamiento del hidrógeno líquido: la conversión de la forma orto a la forma para es exotérmica y produce el calor suficiente para evaporar el hidrógeno líquido, provocando la pérdida del material licuado. Catalizadores para la interconversión orto / para, tales como compuestos de hierro, son usados en procesos de refrigeración con hidrógeno.[14]
Una forma molecular llamada "hidrógeno molecular protonado", H3+, se encuentra en el medio interestelar, donde se genera por la ionización del hidrógeno molecular provocada por los rayos cósmicos. También se ha observado en las capas superiores de la atmósfera de Júpiter. Esta molécula es relativamente estable en el medio del espacio exterior debido a las bajas temperaturas y a la bajísima densidad. El H3+ es uno de los iones más abundantes del universo, y juega un papel notable en la química del medio interestelar.[15]
Hidrógeno metálico
Si bien se suele catalogar al hidrógeno como no metal, a bajas temperaturas y altas presiones puede comportarse como metal. En marzo de 1996, un grupo de científicos del Laboratorio Nacional Lawrence Livermore informó de que habían producido casualmente, durante un microsegundo y a temperaturas de miles de kelvins y presiones de más de un millón de atmósferas (> 100 GPa), el primer hidrógeno metálico identificable.[16]
Aplicaciones
El átomo de hidrógeno no puede aislarse, siempre se encuentra formando moléculas o compuestos. La molécula más sencilla es el hidrógeno diatómico. Para conocer información adicional de alguna sustancia que contiene átomos de hidrógeno, diríjase a los artículos sobre dihidrógeno, hidruro, ácido, o hidrocarburo.
Compuestos
Compuestos covalentes y orgánicos
A pesar de que el H2 no es muy reactivo en condiciones normales, forma multitud de compuestos con la mayoría de los elementos químicos. Se conocen millones de hidrocarburos, pero no se generan por la reacción directa del hidrógeno elemental con el carbono (aunque la producción del gas de síntesis seguida del proceso Fischer - Tropsch para sintetizar hidrocarburos parece ser una excepción pues comienza con carbón e hidrógeno elemental generado in situ). El hidrógeno puede formar compuestos con elementos más electronegativos, tales como los halógenos (flúor, cloro, bromo, yodo) o los calcógenos (oxígeno, azufre, selenio); en estos compuestos, el hidrógeno adquiere carga parcial positiva debido a la polaridad del enlace covalente. Cuando se encuentra unido al flúor, al oxígeno o al nitrógeno, el hidrógeno puede participar en una modalidad de enlace no covalente llamado "enlace de hidrógeno" o "puente de hidrógeno", que es fundamental para la estabilidad de muchas moléculas biológicas. El hidrógeno puede también formar compuestos con elementos menos electronegativos, tales como metales o semi - metales, en los cuales adquiere carga parcial negativa. Estos compuestos se conocen como hidruros.
El hidrógeno forma una enorme variedad de compuestos con el carbono. Debido a su presencia en los seres vivos, estos compuestos se denominan compuestos orgánicos; el estudio de sus propiedades es la finalidad de la Química Orgánica, y el estudio en el contexto de los organismos vivos se conoce como Bioquímica. Atendiendo a algunas definiciones, los compuestos "orgánicos" requieren la presencia de carbono para ser denominados así (ahí tenemos el clásico ejemplo de la urea) pero no todos los compuestos de carbono se consideran orgánicos (es el caso del monóxido de carbono, o los carbonatos metálicos. La mayoría de los compuestos orgánicos también contienen hidrógeno y, puesto que es el enlace carbono-hidrógeno el que proporciona a estos compuestos muchas de sus principales características, se hace necesario mencionar el enlace carbono-hidrógeno en algunas definiciones de la palabra "orgánica" en Química. (Estas recientes definiciones no son perfectas, sin embargo, ya que un compuesto indudablemente orgánico como la urea no podría ser catalogado como tal atendiendo a ellas).
En la Química Inorgánica, los hidruros pueden servir también como ligandos puente que unen dos centros metálicos en un complejo de coordinación. Esta función es particularmente común en los elementos del grupo 13, especialmente en los boranos (hidruros de boro) y en los complejos de aluminio, así como en los clústers de carborano.[7]
Algunos ejemplos de compuestos covalentes importantes que contienen hidrógeno son: amoniaco (NH3), hidracina (N2H4), agua (H2O), peróxido de hidrógeno (H2O2), sulfuro de hidrógeno (H2S), etc.
Hidruros
A menudo los compuestos del hidrógeno se denominan hidruros, un término usado con bastante inexactitud. Para los químicos, el término "hidruro" generalmente implica que el átomo de hidrógeno ha adquirido carga parcial negativa o carácter aniónico (denotado como H-). La existencia del anión hidruro, propuesta por G. N. Lewis en 1916 para los hidruros iónicos del grupo 1 (I) y 2 (II), fue demostrada por Moers en 1920 con la electrolisis del hidruro de litio (LiH) fundido, que producía una cantidad estequiométrica de hidrógeno en el ánodo.[17] Para los hidruros de metales de otros grupos, el término es bastante erróneo, considerando la baja electronegatividad del hidrógeno. Una excepción en los hidruros del grupo II es el BeH2, que es polimérico. En el tetrahidruroaluminato (III) de litio, el anión AlH4- posee sus centros hidrúricos firmemente unidos al aluminio (III).
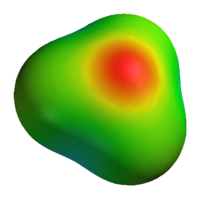 Representación del ion hidronio (H3O+), en la que se puede apreciar la condensación de carga negativa en el átomo de oxígeno, y el carácter positivo de los átomos de hidrógeno.
Representación del ion hidronio (H3O+), en la que se puede apreciar la condensación de carga negativa en el átomo de oxígeno, y el carácter positivo de los átomos de hidrógeno.
Aunque los hidruros pueden formarse con casi todos los elementos del grupo principal, el número y combinación de posibles compuestos varía mucho; por ejemplo, existen más de 100 hidruros binarios de boro conocidos, pero solamente uno de aluminio.[18] El hidruro binario de indio no ha sido identificado aún, aunque existen complejos mayores.[19]
"Protones" y ácidos
La oxidación del H2 formalmente origina el protón, H+. Esta especie es fundamental para explicar las propiedades de los ácidos, aunque el término "protón" se usa imprecisamente para referirse al hidrógeno catiónico o ion hidrógeno, denotado H+. Un protón aislado H+ no puede existir en disolución debido a su fuerte tendencia a unirse a átomos o moléculas con electrones mediante un enlace coordinado o enlace dativo. Para evitar la cómoda, aunque incierta, idea del protón aislado solvatado en disolución, en las disoluciones ácidas acuosas se considera la presencia del ion hidronio (H3O+) organizado en clústers para formar la especie H9O4+.[20] Otros iones oxonio están presentes cuando el agua forma disoluciones con otros disolventes.[21]
Aunque exótico en la Tierra, uno de los iones más comunes en el universo es el H3+, conocido como hidrógeno molecular protonado o catión hidrógeno triatómico.[22]
Véase también
- Dihidrógeno
- Ácido-base
- Agua
- Antihidrógeno
- Biocombustible
- Bomba de hidrógeno
- Celda de hidrógeno
- Deuterio
- Tritio
- Economía del hidrógeno
- Electrólisis
- Energía del futuro
- Enlace de hidrógeno
- Fórmula de Rydberg
- Gas natural
- Hidrocarburo
- Hidrogenera
- Hidrógeno diatómico (gas)
- Hidrógeno triatómico
- Hidrógeno molecular protonado
- Metano
- pH
- Pila de combustible
- Serie de Lyman
- Tecnologías del hidrógeno
- Vehículo de hidrógeno
- Vehículo eléctrico
- Vehículo híbrido
Elementos diatómicos Hidrógeno
H2|
Nitrógeno
N2|
Oxígeno
O2|
Flúor
F2Cloro
Cl2|
Bromo
Br2|
Yodo
I2|
Astato
At2Referencias
- ↑ Hydrogen in the Universe, NASA Website. URL visitada el 2 de junio de 2006.
- ↑ Kubas, G. J., Metal Dihydrogen and σ-Bond Complexes, Kluwer Academic/Plenum Publishers: New York, 2001
- ↑ «Webelements – Hydrogen historical information». Consultado el 15 de septiembre de 2005.
- ↑ Berman R, Cooke AH, Hill RW. Cryogenics, Ann. Rev. Phys. Chem. 7 (1956). 1–20.
- ↑ «Jefferson Lab – Hydrogen». Consultado el 15 de septiembre de 2005.
- ↑ Shriver, D.F.; Atkins, P.W.; Langford, C.H. Química Inorgánica. Vol. 1. Segunda edición. Reverté. 1997.
- ↑ a b c Miessler GL, Tarr DA. (2004). Inorganic Chemistry 3rd ed. Pearson Prentice Hall: Upper Saddle River, NJ, USA
- ↑ Gurov YB, Aleshkin DV, Berh MN, Lapushkin SV, Morokhov PV, Pechkurov VA, Poroshin NO, Sandukovsky VG, Tel'kushev MV, Chernyshev BA, Tschurenkova TD. (2004). Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. Physics of Atomic Nuclei 68(3):491–497.
- ↑ Korsheninnikov AA. et al. (2003). Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. Phys Rev Lett 90, 082501.
- ↑ «Universal Industrial Gases, Inc. – Hydrogen (H2) Applications and Uses». Consultado el 15 de septiembre de 2005.
- ↑ Tikhonov VI, Volkov AA. (2002). Separation of water into its ortho and para isomers. Science 296(5577):2363.
- ↑ NASA Glenn Research Center Glenn Safety Manual. CH. 6 - Hydrogen. Document GRC-MQSA.001, marzo 2006. [1]
- ↑ Milenko YY, Sibileva RM, Strzhemechny MA. (1997). Natural ortho-para conversion rate in liquid and gaseous hydrogen. J Low Temp Phys 107(1-2):77–92.
- ↑ Svadlenak RE, Scott AB. (1957). The Conversion of Ortho-to Parahydrogen on Iron Oxide-Zinc Oxide Catalysts. J Am Chem Soc 79(20); 5385–5388.
- ↑ «H3+ Resource Center». Universities of Illinois and Chicago. Consultado el 09-02-2007.
- ↑ Weir, S.T.; A.C. Mitchell y W. J. Nellis (1996). «Metallization of fluid molecular hydrogen at 140 GPa (1.4 Mbar)» (en inglés). Physical Review Letters 76: pp. 1860. doi:.
- ↑ K. Moers, (1920). 2. Z. Anorg. Allgem. Chem., 113:191.
- ↑ Downs AJ, Pulham CR. (1994). The hydrides of aluminium, gallium, indium, and thallium: a re-evaluation. Chem Soc Rev 23:175–83.
- ↑ Hibbs DE, Jones C, Smithies NA. (1999). A remarkably stable indium trihydride complex: synthesis and characterization of [InH3{P(C6H11)3}]. Chem Commum 185–6.
- ↑ Okumura M, Yeh LI, Myers JD, Lee YT. (1990). Infrared spectra of the solvated hydronium ion: vibrational predissociation spectroscopy of mass-selected H3O+•H2On•H2m.
- ↑ Perdoncin G, Scorrano G. (1977). Protonation equilibria in water at several temperatures of alcohols, ethers, acetone, dimethyl sulfide, and dimethyl sulfoxide. 99(21); 6983–6986.
- ↑ Carrington A, McNab IR. (1989). The infrared predissociation spectrum of triatomic hydrogen cation (H3+). Accounts of Chemical Research 22:218–22.
Bibliografía adicional
- Shriver, D.F; Atkins, P.W; Langford, C.H. "Química Inorgánica. Vol. 1" Segunda edición. Reverté. 1997 ISBN 84-291-7004-9
- Greenwood, N.N; Earnshaw, A. "Chemistry of the Elements" Second edition. Butterworth - Heinemann. 1997 ISBN 0-7506-3365-4
- Cotton, F.A.; Wilkinson, G. "Advanced Inorganic Chemistry: a comprehensive text" Fourth edition. John Wiley & Sons. 1980. ISBN 0-471-02775-8
- Gutiérrez Ríos, E. "Química Inorgánica" Reverté. 1994. ISBN 84-291-7215-7
Enlaces externos
 Wikiquote alberga frases célebres de o sobre Hidrógeno. Wikiquote
Wikiquote alberga frases célebres de o sobre Hidrógeno. Wikiquote Wikimedia Commons alberga contenido multimedia sobre HidrógenoCommons.
Wikimedia Commons alberga contenido multimedia sobre HidrógenoCommons. Wikcionario tiene definiciones para hidrógeno.Wikcionario
Wikcionario tiene definiciones para hidrógeno.Wikcionario- WebElements.com
- EnvironmentalChemistry.com
- Es Elemental
- Actualidad sobre el uso del hidrógeno en coches
- Imágenes del Átomo de Hidrógeno
- El hidrógeno como combustible
Categorías:- Hidrógeno
- Bioelementos
- Este artículo trata sobre un elemento químico. Para la molécula (H2), formada por dos átomos de hidrógeno, véase Dihidrógeno.
Wikimedia foundation. 2010.