- Voltamperometría
-
La voltamperometría es una categoría de los Métodos electroanalíticos usados en Química Analítica y varios procesos industriales. En voltamperometría, la información sobre un analito se obtiene midiendo la corriente cuando se modifica el potencial.[1] [2]
Contenido
Sistema de tres electrodos
Los experimentos de voltamperometría investigan la reactividad en la semicelda de un analito. La mayoría de los experimentos controlan el potencial (Voltios) de un electrodo en contacto con el analito, mientras que se mide la corriente resultante (Amperios).[3]
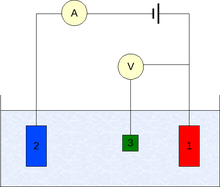
Para llevar a cabo un experimento se requieren al menos dos electrodos. El electrodo de trabajo, que hace contacto con el analito, debe aplicar el potencial deseado de una manera controlada y facilitar la transferencia de electrones desde y hacia el analito. Un segundo electrodo actúa como la otra semicelda. Este segundo electrodo debe tener un potencial conocido con el que medir el potencial del electrodo de trabajo, además, se deben equilibrar los electrones añadidos o eliminados por el electrodo de trabajo. Si bien esta es una configuración viable, tiene una serie de deficiencias. Más significativamente, es extremadamente difícil para un electrodo mantener un potencial constante mientras que pasa la corriente para hacer frente a los eventos redox del electrodo de trabajo.
Para resolver este problema, el papel de proveedor de electrones y el de potencial de referencia se ha dividido entre dos electrodos separados. El electrodo de referencia es una semicelda con un potencial de reducción de conocido. Su única función es actuar como referencia en la medición y controlar el potencial de los electrodos de trabajo y en ningún momento pasa ninguna corriente. El electrodo auxiliar pasa toda la corriente necesaria para equilibrar la corriente observada en el electrodo de trabajo. Para lograr esta corriente, el auxiliar a menudo oscila a los potenciales extremos en los bordes de la ventana de disolvente, donde se oxida o reduce el solvente o electrolito de apoyo. Estos electrodos, el de trabajo, el de referencia, y el auxiliar constituyen el moderno sistema de tres electrodos.
Hay muchos sistemas que tienen más electrodos, pero sus principios de diseño son generalmente los mismos como el sistema de tres electrodos. Por ejemplo, el electrodo de disco-anillo rotatorio tiene dos electrodos de trabajo distintos y separados, un disco y un anillo, que puede usarse explorar o mantener potenciales independientemente uno del otro. Ambos electrodos están equilibrados por una simple combinación del de referencia y el auxiliar para formar un diseño de cuatro electrodos. Experimentos más complicados pueden añadir tantos electrodos de trabajao como se requiera y a veces electrodos de referencia y auxiliar.
En la práctica puede ser muy importante contar con un electrodo de trabajo con características de dimensiones y superficie conocidas. Como resultado de ello, es común limpiar y pulir los electrodos de trabajo con regularidad. El electrodo auxiliar puede ser casi cualquier cosa con tal que no reaccione con la mayor parte de la solución del analito y conduzca bien. El de referencia es el más complejo de los tres electrodos, se utilizan una variedad de estándares y que vale la pena investigar. Para trabajos no acuosos, la IUPAC recomienda el uso de la pareja ferroceno/ferrocenium como un estándar interno. En la mayoría de los experimentos de voltamperometría un electrolito inerte (también conocido como electrolito soporte) se utiliza para reducir al mínimo la resistencia de la solución. Puede ser posible realizar un experimento sin un electrolito soporte, pero la resistencia añadida enormemente reduce la exactitud de los resultados. En el caso de líquidos iónicos a temperatura ambiente iónico el disolvente puede actuar como electrolito.
Teoría
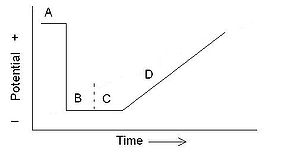
El análisis de datos requiere la consideración de la cinética, además de la termodinámica, debido al componente temporal de la voltamperometría. Idealizadas relaciones termodinámicas electroquímicas teóricas, tales como la ecuación de Nernst están elaboradas sin una componente de tiempo. Aunque estos modelos son insuficientes por sí mismos para describir los aspectos dinámicos de la voltamperometría, modelos como la ecuación de Nernst y la ecuación de Butler-Volmer sientan las bases para las relaciones de voltamperometría modificadas que relacionan la teoría con los resultados observados.[4]
Tipos de voltamperometría
- voltamperometría de barrido lineal
- voltamperometría escalonada
- voltamperometría de onda cuadrada
- voltamperometría cíclica - Un método voltamétrico que se pueden utilizar para determinar los coeficientes de difusión y los potenciales de reducción de semiceldas.
- Voltamperometría de redisolución anódica – Un método de análisis cuantitativo para el análisis de trazas de cationes metálicos. El analito se deposita ( electrolíticamente) sobre el electrodo de trabajo durante una etapa de deposición, y luego se oxida durante la etapa de extracción. La corriente se mide durante la etapa de extracción.
- Voltamperometría de redisolución catódica – Un método de análisis cuantitativo para el análisis de trazas de aniones. Cuando se aplica un potencial positivo, se produce la oxidación del electrodo de mercurio y la formación de precipitados insolubles de los aniones. Un potencial negativo reduce entonces (tiras) de la película (tiras) depositada en la solución.
- Voltamperometría de redisolución de adsorción – Un método de análisis cuantitativ para el análisis de trazas. El analito se deposita simplemente por adsorción en la superficie del electrodo (es decir, sin electrólisis), y luego se electroliza para dar la señal analítica. Se utilizan a menudo electrodos modificados químicamente.
- Voltamperometría de corriente alterna
- Polarografía – Una subclase de voltamperometría donde el electrodo de trabajo es un electrodo de gota de mercurio (DME), útil por su amplio rango catódico y superficie renovable.
- Voltamperometría de electrodo rotatorio – Una técnica hidrodinámica en la que el electrodo de trabajo]], usualmente un electrodo de disco rotatorio (RDE) or el electrodo de disco-anillo rotatorio (RRDE), rota a muy alta velocidad. Esta técnica es útil para estudiar la cinética y los mecanismos de reaccion electroquímicos para una semirreacción.
- Voltamperometría de pulso normal
- Voltamperometría de pulso diferencial
- Cronoamperometría
Historia
El comienzo de la voltamperometría se vio facilitado por el descubrimiento de la polarografía en 1922 por el Premio Nobel de Química Jaroslav Heyrovský. Las primeras técnicas de voltamperométricas tuvieron muchos problemas, que limitaban su viabilidad para el uso diario en la química analítica. En 1942 Hickling construyó el primer potenciostato de tres electrodos.[5] Los años 1960 y 1970 fueron testigos de muchos avances en la teoría, la instrumentación, y la introducción de sistemas añadidos y controlados por computadoras. Estos avances mejoraron la sensibilidad y crearon nuevos métodos analíticos. La industria respondió con la producción más barata de potenciostatos, de electrodoss, y de las celdas que podrían ser utilizados eficazmente en el trabajo analítico de rutina.
Aplicaciones
Sensores voltamperométricos
Comercialmente se producen un gran número de sistemas de voltamperométricos para la determinación de determinadas especies que son de interés en la industria y la investigación. Estos dispositivos se denominan a veces electrodos, pero son, de hecho, celdas voltamperométricas completas y son más conocidas como sensores.
Electrodo de oxígeno
La determinación del oxígeno disuelto en una variedad de entornos acuáticos, como el agua de mar, la sangre, las aguas residuales, los efluentes de plantas químicas, y los suelos es de enorme importancia para la industria, la investigación biomédica y del medio ambiente, y la medicina clínica. Uno de los métodos más comunes y convenientes para hacer estas mediciones es el sensor de Clark, que fue patentado por L.C. Clark, Jr. en 1956.
Véase también
- Método electroanalítico
- Voltamperometría cíclica
- Electrodo de trabajo
- Electrodo de referencia
- Electrodo auxiliar
Referencias
- ↑ CRC, ed (23-01-1996). Laboratory Techniques in Electroanalytical Chemistry, Second Edition, Revised and Expanded. ISBN 0824794451.
- ↑ Elsevier Science, ed (07-02-2007). Handbook of Electrochemistry. ISBN 0444519580.
- ↑ Wiley, ed (18-12-2000). Electrochemical Methods: Fundamentals and Applications (2 edición). ISBN 0471043729.
- ↑ «Theory of Stationary Electrode Polarography. Single Scan and Cyclic Methods Applied to Reversible, Irreversible, and Kinetic Systems.». Analytical Chemistry. 1964-04-01. doi:. http://dx.doi.org/10.1021/ac60210a007.
- ↑ «Studies in electrode polarisation. Part IV.-The automatic control of the potential of a working electrode». Transactions of the Faraday Society 38: pp. 27–33. 1942. http://dx.doi.org/10.1039/TF9423800027.
- Este artículo fue creado a partir de la traducción del artículo Voltammetry de la Wikipedia en inglés, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Otras lecturas
- «Theory of Stationary Electrode Polarography». Analytical Chemistry 33: pp. 1793–1794. 1961-11-01. doi:. http://dx.doi.org/10.1021/ac60180a004.
- Harcourt Brace College Publishers, ed (25-08-1995). Fundamentals of Analytical Chemistry (7th edición). ISBN 0030059380.
- Royal Society of Chemistry, ed (01-10-2003). Inorganic Electrochemistry: Theory, Practice, and Application (1 edición). ISBN 0854046615.
Enlaces externos
- http://www.drhuang.com/science/chemistry/electrochemistry/polar.doc.htm
- http://www.autolab-instruments.com/download/content/Appl021.pdf
- http://www.amelchem.com/download/items/voltammetry/manuals/eng/manual_eng.pdf
- http://new.ametek.com/content-manager/files/PAR/App%20Note%20E-4%20-%20Electrochemical%20Analysis%20Techniques1.pdf
- http://www.prenhall.com/settle/chapters/ch37.pdf
Wikimedia foundation. 2010.