- Ácido wolfrámico
-
Ácido wolfrámico
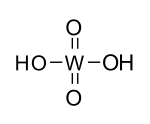
Nombre (IUPAC) sistemático n/d General Otros nombres Ácido ortowolfrámico Fórmula molecular H2WO4 Identificadores Número CAS 7783-03-1 Propiedades físicas Estado de agregación sólido Apariencia polvo amarillo Densidad 5590 kg/m3; 5.59[1] g/cm3 Masa molar 249,85 g/mol g/mol Punto de descomposición 373 K ( °C) Propiedades químicas Acidez (pKa) 3,5 (1ª disociación)
4,6 (2ª disociación)[2]Solubilidad en agua insoluble[3] Solubilidad en metanol soluble en HF, NH3 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl ácido wolfrámico es el nombre que se da a las formas hidratadas del trióxido de wolframio, WO3. La forma más simple es el monohidrato, de fórmula WO3.H2O, pero el dihidrato, WO3.2 H2O, es también conocido.
La fórmula molecular de laforma monohidrato del trióxido de wolframio es H2WO4, pero a diferencia de lo que parece ser un análogo del ácido sulfúrico (H2SO4), no hay moléculas discretas de H2WO4, y en su lugar, el ácido wolfrámico consiste en una capa de octaedros WO6 en red.
Estructuras
La estructura en estado sólido del monohidrato, WO3.H2O, consiste en capas de unidades WO5(H2O) octaédricamente coordinadas en los que son compartidos 4 vértices.[4] El monohidrato es un sólido amarillo e insoluble en agua. El nombre clásico de este ácido es "ácido de tungsteno".
El dihidrato tiene la misma estructura en capas con las moléculas adicionales de H2O intercaladas entre las capas.[4]
Los aniones del ácido wolfrámico son los wolframatos, WO42-, y poseerán, de forma análoga a los iones sulfato, geometría tetraédica.[2]
Obtención
Se obtiene, entre otras formas, por acidificación de las soluciones de wolframato y calefacción cuidadosa de la forma dihidratado (WO3·2 H2O), inicialmente precipitada. Fue aislado por primera vez en 1781 por Carl Wilhelm Scheele, en Köping.
Referencias
- ↑ Entrada para el ácido wolfrámico en la base de datos GESTIS del Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA). Consultado el 30 de Agosto de 2007}}
- ↑ a b A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. Walter de Gruyter & Co. Berlin 1995, 101. Auflage, ISBN 3-11-012641-9.
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
Wikimedia foundation. 2010.
