- Ácido fluorhídrico
-
Ácido fluorhídrico
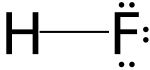
Nombre (IUPAC) sistemático n/d General Otros nombres Fluoruro de hidrógeno Fórmula semidesarrollada HF(aq) Fórmula estructural HF Fórmula molecular n/d Identificadores Número CAS 7664-39-3 Propiedades físicas Estado de agregación líquido Apariencia incoloro Densidad 1.140 kg/m3; 1.14 g/cm3 Masa molar 20,01 g/mol Punto de fusión 190 K (-83,15 °C) Punto de ebullición 293 K (19,85 °C) Propiedades químicas Acidez (pKa) 3,19 Solubilidad en agua >70 g/100 ml agua (20 °C, 293 K) Momento dipolar 1,98 D Peligrosidad NFPA 704 Riesgos Muy alto LD50 180 mg/kg Más información Cloruro de hidrógeno; Bromuro de hidrógeno; Fluoruro de sodio; Fluoruro de calcio; Teflón Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl ácido fluorhídrico es la solución acuosa de fluoruro de hidrógeno, compuesto químico formado por hidrógeno y flúor (HF)X. No debe ponerse en contacto con elementos de vidrio ya que puede corroerlo, por esto se manipula utilizando material de plástico. La forma más común en el que podemos encontrarlo en la naturaleza es HF o (HF)6.
Contenido
Obtención
El fluorhídrico se obtiene habitualmente por acción de ácido sulfúrico sobre fluoruro de calcio CaF2 (fluorita):
H2SO4 + CaF2 -> CaSO4 + 2 HF
Una fuente de contaminación con fluorhídrico es la producción de abono a partir de fosfato ya que, en una reacción secundaria, las trazas de fluoroapatita presente en el mineral empleado liberan este gas. Se trata de una sustancia volátil, tóxica, altamente corrosiva y miscible con agua. Ataca el silicato del vidrio formando tetrafluoruro de silicio SiF4 o ácido hexafluorosilicato H2SiF6 respectivamente. En estado líquido se forman agregados (p. ej. (HF)6 debido a puentes de hidrógeno, parecido a lo que pasa en el agua. Esto explica el punto de ebullición anormalmente elevado de 19,5 °C comparándolo con el clorhídrico (HCl) de -85,05 °C. Disuelto en agua forma una disolución ácida altamente corrosiva.
Datos fisicoquímicos
- LD50: 180 mg/kg
- Concentración máxima permitida en los lugares de trabajo: 2 ppm
Aplicaciones
El fluorhídrico se utiliza en química orgánica en la obtención de compuestos orgánicos fluorados, como catalizador en petroquímica, para obtener criolita (Na3AlF6) artificial que se emplea en la obtención del aluminio, fluoruros inorgánicos como el hexafluoruro de uranio (UF6) y a veces como disolvente. También es utilizado en la industria y preparación de vidrio o cristal en el tallado y grabado del mismo. En estudios petrográficos de rocas graníticas es utilizado en estado puro para atacar con sus vapores los silicatos que componen la roca, para luego de un suave lavado con agua destilada ser cubierto con cobalto-nitrito de sodio el cual pintara selectivamente de un color amarillo intenso los feldespatos de potasio, que luego podrán ser distinguidos de los feldespatos plagioclasa en base a su color y de esta manera se podrá clasificar la roca ígnea.
Toxicología
Se trata de una sustancia irritante, corrosiva y tóxica. En la piel produce quemaduras muy dolorosas que curan muy mal. Esto se debe a que el calcio necesario en el proceso de curación precipita con los fluoruros como fluoruro cálcico (CaF2). En caso de haberse producido una quemadura con fluorhídrico se recomienda lavar con abundante agua y tratar como primera medida con un gel de gluconato de calcio (que debe estar disponible en todos los lugares donde haya o se maneje esta sustancia), en su defecto, utilizar una disolución de lactato cálcico o citrato cálcico o en su defecto con leche. En caso de aspiración de vapores, se trata de una emergencia médica. Se trata aplicando oxígeno por máscara (se desaconseja por irritantes otros materiales) si el afectado respira, controlando su nivel de conciencia. Llegado el caso, se debe aplicar resucitación de la persona afectada si fuera necesario. En caso de salpicaduras en los ojos, solamente tratar con solución fisiológica estéril en muy abundante cantidad; al igual que la respiración, se desaconseja por irritante sustancias basadas en compuestos cálcicos. En absolutamente todos los casos, se debe tratar en forma médica avanzada luego de prestar los primeros auxilios.
Enlaces externos
Categorías:- Hidrácidos
- Fluoruros
Wikimedia foundation. 2010.

