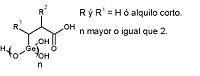- Química bioorganometálica
-
Química bioorganometálica
Química bioorganometálica
Se denomina química bioorganometálica a la rama de la [[química organometálica]] que estudia los efectos de los compuestos organometálicos sobre la salud de los seres vivos y su impacto medioambiental.
A nivel humano, son pocos los metales que se absorben significativamente en forma de compuestos organometálicos; todos suelen hacerlo en forma de sal inorgánica.
La EPA (Environmental Protection Agency) de EEUU publica anualmente una lista con los compuestos químicos más potencialmente peligrosos para el medio ambiente. Entre estos, hoy en día podemos encontrar: Ni(CO)4, (C5H4CH3)Mn(CO)3, Co(CO)6, AcOHgPh, Pb(Et)4.
En apartados posteriores se ofrece una explicación del metabolismo de los metales en los seres vivos; un metabolismo que se basa fundamentalmente en la biometilación, un proceso que tiene lugar sobre todo en sedimentos, estuarios, ríos, lagos y océanos y se basa en la adición de un grupo metilo a un metal o metaloide, que entonces, cambia sustancialmente sus propiedades físicas, químicas y biológicas, incluyendo su toxicidad.
Los principales agentes biometilantes son bacterias anaeróbicas que residen en sedimentos o zonas acuáticas con un defecto de oxígeno. Algunas bacterias aeróbicas también son capaces de biometilar los metales(/oides), así como ciertos hongos y algas. En seres avanzados, como los seres humanos, la vitamina B12 juega un papel fundamental.
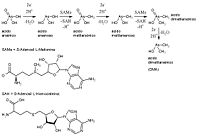
Varios derivados de hidruros y metilos metálicos volátiles pueden encontrarse en gases liberados en espacios naturales: gases geotérmicos, plantas de tratamiento de aguas residuales, sedimentos marinos, vertederos, etc. Podemos definir como protagonistas 3 moléculas orgánicas que actúan como agentes biometilantes: S-Adenosilmetionina (SAM), metilcobalamina (vitamina B12, R = CH3), ý N-metiltetrahidrofolato.
El SAM se sintetiza por la transferencia del grupo adenosilo desde una molécula de ATP al átomo de azufre de la metionina. Así el átomo de azufre queda cargado positivamente, activándose el grupo metilo vecino, haciendo que SAM sea un excelente dador del ión metilcarbonio [(CH3)+]. SAM funciona bien al metilar Se, Te, P ý Sb; todos con un par de electrones no compartido, lo que garantiza la interacción nucleófilo-electrófilo.
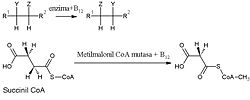
N-metiltetrahidrofolato transfiere un ion [(CH3)+] o el radical metilo (radical intermediario), (•CH3), pero no es tan eficaz como el SAM. Por lo que a la metilcobalamina refiere, el grupo metilo se transfiere en forma de carbanión (-CH3), por lo que el ataque se realiza sobre metales pobres en electrones u otros sustratos electrófilos, como puede ser el ion (Hg2)+2. Esta molécula metila eficazmente centros como Pb, Sn, Pd, Pt, Au ý Tl. Aunque la metilcobalamina sea en esencia el único agente metilante natural conocido que transfiera iones (-CH3), estos carbaniones también pueden ser transferidos desde moléculas organometálicas que se forman por la metabolización de otros complejos: Me3Pb+, Me3Sn+.
1. Organomercurio.
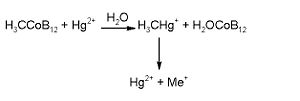
El mercurio puede encontrarse en los seres humanos en forma de (H3CHg)+ y en forma de (H3C)2Hg. Este último, junto con su homólogo etílico pueden llegar a absorberse en un 80%, una absorción considerablemente menor que la de especies fenílicas y metoxietílicas. La vida media del dimetilmercurio es de 1,5 meses, por lo que suele acumularse en los tejidos. Es un compuesto capaz de atravesar la membrana hematoencefálica por activación con L-cisteína. También atraviesa la placenta. La farmacocinética del etilmercurio (cuya vida media no llega a una semana)es muy diferente a la del metilmercurio. Dada la naturaleza de sus cadenas alquílicas, este compuesto β-elimina y no forma complejos con la L-cisteína, por lo que rápidamente descompone a mercurio inorgánico dando concentraciones de mercurio menores en el cuerpo. El metilmercurio se acumula en el pelo 250 veces más que en la sangre. Su excreción fecal en humanos que comieron atún contaminado fue determinada como mercurio inorgánico. La excreción urinaria de arilmercurios también fue determinada como mercurio inorgánico. Por lo que refiere al metabolismo, el mercurio inorgánico ingerido achaca su toxicidad a la formación de los compuestos organometálicos mencionados anteriormente, fruto de metilaciones soportadas por la coenzima B12. Esta biometilación se favorece a pH bajos y concentraciones altas de sulfatos:
1.1. Coenzima B12.
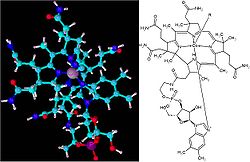
Las primeras ideas sobre microcomponentes esenciales para la vida provienen de la curación del escorbuto. A lo largo de la historia se fueron descubriendo compuestos que introducidos en la dieta ayudaban en la curación y/o prevención de varias enfermedades. Dado que los primeros compuestos eran aminas, se les llamó [[vitaminas]]. En 1948 se consiguió separar y cristalizar una sustancia del extracto de riñón que tenía propiedades curativas hacia la anemia. Más tarde, en 1965, Dorothy Hodgkin determinó su estructura:
Como se observa en la figura, se trata de un complejo octaédrico de Co(II), rodeado en el plano ecuatorial por un anillo de 15 miembros coordinado por 4 nitrógenos que forman parte de este anillo denominado núcleo corrínico. En las posiciones axiales encontramos una cadena que contiene el grupo benzimidazol. La sexta vacante coordinativa puede ser ocupada por diferentes ligandos, dependiendo fundamentalmente del entorno físico de aislamiento de la vitamina; suelen ser grupos sencillos. Debido al proceso más común de su aislamiento, este grupo es generalmente el grupo –CN, dándose entonces lugar a la cianocobalamina. En la naturaleza otros grupos suelen coordinar al cobalto en esta estructura: -OH2 (acuocobalamina [B12a]), -CH3 (metilcobalamina), -adenosilo, etc. La coenzima B12 actúa con enzimas que catalizan reacciones de 3 tipos:
i) ISOMERASAS: 2 sustituyentes de carbonos adyacentes se permutan.
ii) REACCIONES EN LAS QUE LA METILCOBALAMINA METILA UN SUSTRATO:
iii) REACCIONES EN LAS QUE LA VITAMINA B12 CONVIERTE LA RIBOSA DE LOS RIBONUCLEÓTIDOS QUE FORMAN EL RNA EN DESOXIRIBOSA DE LOS DESOXIRIBONUCLEÓTIDOS QUE FORMAN EL DNA:
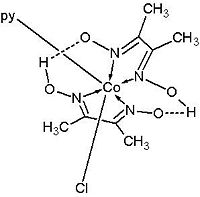
Las necesidades humanas de vitamina B12 son muy pequeñas (400–800 μg/día), y el cuerpo ya almacena fundamentalmente en el hígado entre 2 ý 5 mg, por lo que no suelen haber afecciones por deficiencia de dicho microcomponente. En tal caso se sucede una dificultad para formar eritrocitos (anemia); pero este tipo de anemia no se cura con los mismos tratamientos que la anemia perniciosa (carencia de hierro). El sistema B12a es fácilmente reducible: en primer lugar a B12r (B12 reducida) y posteriormente a B12s (B12 super-reducida). Diversos estudios han demostrado que B12r contiene Co(II), mientras que B12s contiene Co(I). Así, el sistema B12s es un potente nucleófilo que reacciona rápidamente con H3CI o algún donador natural de cationes (CH3)+ como el N5-Metil-tetrahidrofolato, para dar la metilcobalamina. La dimetilglioxima (dmgH) compleja al cobalto para dar una serie de complejos de Co(III), llamados cobaloximas, que al tener 4 posiciones coordinadas a nitrógeno de manera coplanar y formando un anillo similar al núcleo corrínico; si otro sustituyente también tiene una naturaleza N-heterocíclica, puede simular correctamente el sistema B12.
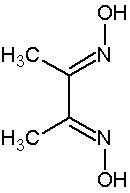

Estos compuestos con núcleo corrínico son estables cuando los ligandos del plano ecuatorial tienen suficiente, pero no demasiada deslocalización electrónica. Los sustituyentes axiales no β-eliminan fácilmente, ya que el reordenamiento de los átomos es demasiado dificultoso, debido a la rigidez del núcleo corrínico.
Las cobaloximas pueden reducirse a B12r y B12s. La forma con Co(I) [Co(dmg)2py]- demostró ser un nucleófilo poderoso que reacciona rápidamente, como era de esperar con H3CI para dar [MeCo(dmg)2py] + I-. Sobre el mecanismo de reacción de las isomerasas se cree que pueda incluir un inicio en el cual haya una rotura homolítica reversible del enlace Co(III)–C de la coenzima B12 para generar el radical Co(II) y el radical •RCH2, que sustrae un hidrógeno del sustrato QH para dar RCH3 i Q•. Probablemente, este radical sufra una migración 1,2 del grupo X para dar el radical producto. La transferencia de un átomo de hidrógeno desde el RCH3 hasta el radical producto, da el producto final:
Este mecanismo supone que el enlace Co-C en la coenzima no es bastante fuerte, dado que la rotura homolítica inicial debe ser espontánea a temperatura ambiente, como para conseguir un ciclo de reacciones lo suficientemente rápido como lo observado en las enzimas que basan su acción en la coenzima B12 (≈102 sec-1).
1.2. Desmetilación.
Para ciertos metales, tales como el Sn ý el Hg, una desalquilación asistida por microorganismos es crucial para reducir la toxicidad de los mismos. La enzima Organomercúrico liasa (OL) rompe el enlace Hg-C, que da lugar a una especie de Hg(II) que posteriormente se reduce a Hg(0) por medio de la enzima Mercurio reductasa (MR). El Hg(0) es menos tóxico y más volátil, por lo que puede eliminarse con mayor facilidad.
2. Arsénico.
El arsénico es metabolizado por diversos microorganismos tanto aeróbicos como anaeróbicos tales como: Scopularopsis brevicaulis, Penicillim sp, Gliocladium roseum, Cryptococcus humicola, Flavobacterium sp, Escherichia coli ý Aeromonas sp. Esta metabolización, incluye la metilación, dando lugar a la formación y excreción de compuestos mono- y dimetilados. En la mayoría de animales, solo se metilan los compuestos de As (III). En esta vía metabólica, la S-Adenosilmetionina es el principal agente metilante.
Este proceso de metilación se lleva a cabo fundamentalmente en el hígado. La absorción se centra esencialmente en el As(III), en forma de arsenito; el arsenato [As(V)] es menos tóxico que el arsenito y se reduce rápidamente a As(III) en la sangre. La sangre lo transporta a los órganos, donde se inicia la metilación.
3. Níquel.
El compuesto de níquel más tóxico para los humanos es el Ni(CO)4, un líquido incoloro y volátil, cuya administración afecta principalmente al cerebro y los pulmones. Es un potencial carcinogénico. Los intoxicados por Ni(CO)4 atraviesan 2 fases: la primera dura entre 4 y 5 horas, seguida de un período de remisión que suele ser de 12 horas, aunque puede extenderse a los 4 días. La sintomatología inmediata es dolor de cabeza, vértigo, náuseas, vómitos, insomnio, irritabilidad, disforia e irritación de la parte superior del tracto respiratorio. Más tarde, la fase de remisión se caracteriza por síntomas como dolores agudos en el pecho, tos seca; pueden observarse síntomas de malestar gastrointestinal, sudoración, alucinaciones, y cansancio extremo. En casos más extremos se diagnostican disnea, cianosis, taquicardias, neumonitis y también puede generarse un edema pulmonar. En casos aislados se observaron edemas y hemorragias cerebrales.
4. Estaño.
La toxicidad de los derivados organometálicos de estaño depende de la naturaleza y complejidad de las cadenas alquílicas y/o los aril-sustituyentes, dado que estos determinan los metabolitos que se desprenderán. Los alquilestaños pueden clasificarse en 4 grandes grupos: RSnX3, R2SnX2, R3SnX ý R4Sn. Las especies RSnX3 son poco tóxicas y no se activan por vías metabólicas, algunas especies R3SnX como TMT (cloruro de trimetilestaño) y TET (cloruro de trietilestaño) son especialmente dañinos para el sistema nervioso central (SNC). Las especies R4Sn son muy poco tóxicas, pero se metabolizan a especies R3SnX, causando efectos tóxicos. Las exposiciones oculares y dérmicas a especies de tributilestaño causan irritación e inflamación. La inhalación de dichos vapores provoca irritación de la faringe, tos, náuseas y vómitos. En cambio la exposición a especies de trimetil y trietilestaño causan un malestar más general: náuseas, dolores de estómago, problemas de visión, siendo el síntoma más grave, el acortamiento de la respiración. Aun así, si la exposición a estas últimas especies se prolonga, se derivan múltiples afecciones al SNC: migrañas, apatía, somnolencia, pérdida de memoria, convulsiones, coma y la muerte como último síntoma. En especial, el trimetilestaño es una neurotoxina que provoca cambios de comportamiento y daña áreas del sistema límbico y el córtex cerebral. Los síntomas pueden aparecer entre las 3 primeras horas hasta los 3 días, en función de la dosis administrada y los síntomas neurológicos y psiquiátricos se resumen a migrañas, insomnio, fatiga, pérdida de oído, visión borrosa, desvarío, confusión, desorientación, agresividad, ataques de furia, depresión y comportamiento psicótico. En casos aislados se describen ataques epilépticos y para dosis altas y tiempos de exposición prolongados se suceden el coma, depresión respiratoria y finalmente la muerte. El trietilestaño ataca la mielina de las neuronas produciendo edemas cerebrales y descoordinación motriz. El caso más trágico que se recuerda de este tipo de intoxicación involucró unos 200 casos, de los cuales 100 fueron letales, en 1954: Se preparó para el tratamiento contra estafilococos una medicina que contenía como ingrediente principal Et2SnI2, desafortunadamente, la síntesis de este fármaco escatimó en gastos de purificación, por lo que había impurezas, entre las cuales, Et3SnI.
5. Efectos sobre la membrana celular.
Se cree que la principal vía de daño de muchos compuestos organometálicos tóxicos se debe a la oxidación de la membrana bilipídica celular por acción de sus radicales libres. Por otra parte, sustancias antioxidantes como la vitamina C, los tocoferoles, carotenoides o flavonoides pueden actuar contra dicha oxidación, por lo que se indica recientemente que la ingesta habitual y regulada de frutas y verduras puede tener un efecto positivo en contra de la generación de tumores. El mecanismo de anti-oxidación aun se desconoce, pero dada la naturaleza polifenólica de estos antioxidantes, se les puede considerar excelentes recaptadores de radicales peróxido, hidroxilo y superóxido. Además los flavonoides se conocen por poder quelar algunos metales de transición. La quercitina (Que) pertenece al grupo de los flavonoides más conocidos y estudiados, encontrándose en frutas y verduras. Que, es un buen recaptador de especies radicalarias y activas del oxígeno, por lo que puede inhibir la oxidación radicalaria de la membrana bilipídica celular, reduciendo el daño neuronal y al DNA que estos efectos suelen causar y particularmente, reduciendo el daño de estos radicales sobre el plasma sanguíneo.
6. Aplicaciones biomédicas.
El cuerpo humano contiene numerosas macromoléculas organometálicas con: Fe (transferina, hemoglobina), Zn (carbónico anhidrasa), Cu (hepatocuperina). Del mismo modo, durante años se han usado diversos compuestos organometálicos para el tratamiento pseudosencillo de muchas enfermedades y males: Merbromina, Mercromina (mercurio como antiséptico), Sulfadizina de plata (profiláctico para quemaduras), Arsfenamina (arsénico contra la malaria), ácido 4-ureidofenilarsónico (tratamiento terapéutico para varias enfermedades neurológicas). De manera más general podemos atribuir a compuestos de los siguientes metales, unas finalidades concretas: Au (artritis), Ag (antiséptico y profiláctico), As ý Sb (bactericidas), Bi (daños dérmicos, diarrea y desórdenes alimentarios), Co (en forma de vitamina B12 para aumentar el metabolismo basal), Cu (alguicida, fungicida e insecticida), Ga (agente antitumoral), Hg (antiséptico), Li (depresión y trastornos de conducta), Mn (fungicida y tratamiento contra el mal de Parkinson), Os (tratamiento contra la artritis), Pt ý Pd (agentes antitumorales), Rb (sustituyente del K en distrofias musculares y agente protector contra los efectos coronarios adversos de algunas drogas sintéticas), Ru, Rh ý Os (agentes antitumorales bajo investigación), Sn (bactericida y fungicida), Ta ý Si (implantes de naturaleza fundamentalmente estéticas), Zn (fungicida), etc.
6.1. Polímeros. El uso de drogas poliméricas engendra varias ventajas:
i) Lanzamiento controlado y progresivo de sus principios activos.
ii) La aplicación externa de otras medicinas por difusión transdérmica se facilita para más cantidad de compuestos volátiles e hidrosolubles.
iii) El control de la longitud de las cadenas puede permitir el pase o no del polímero a través de diversas membranas del cuerpo.
iv) Estos polímeros, al lanzar controladamente sus principios activos, pueden aumentar la concentración de dichos principios selectivamente en diversos medios.
6.1.1. Ferroceno.
El centro metálico del ferroceno podría actuar como centro redox para reducir la concentración de oxidantes que causan daño a las células por acción de sus radicales libres, que son aceptados como carcinogénicos y cancerígenos. Los radicales superóxido, hidrogenoperóxido e hidroxilo se generan en la célula durante la respiración celular. La peróxido dismutasa, convierte el superóxido en hidrogenoperóxido y oxígeno, luego ciertas catalasas y la glutionina se encargan de eliminar el hidrogenoperóxido, evitando reacciones en cadena, los productos de las cuales atacan al DNA, causando errores de replicación en la mitosis. El ferroceno es oxidado a catión ferrocenio por los iones radicales hidroxilo: (•OH -OH). La incorporación de ferroceno en forma soluble podría favorecer la eliminación de radicales libres, actuando como antioxidante y preventor de tumores, probablemente mediante la síntesis de polímeros adecuados.
6.1.2. Moderación de la toxicidad del OsO4 por polímeros.
Se sintetizaron varios polímeros de osmio y carbohidratos, que fueron propuestos como agentes para el tratamiento de la artritis. La idea surgió del uso del OsO4 para dichos tratamientos en la Europa de los’40-’50, con los cuales, se inyectaba una solución de OsO4 en las articulaciones afectadas. Desafortunadamente, este compuesto es altamente tóxico, y estas inyecciones permanecían en el cuerpo hasta 5 años, provocando trastornos serios provenientes de la exposición tan prolongada. Los polímeros mencionados, se preparan por reacción del Os(OAc)4 con glucosa, obteniéndose polímeros polianiónicos esféricos con pesos moleculares comprendidos entre los cientos y miles de g•mol-1.
6.1.3. Polímeros para la quelación de metales.
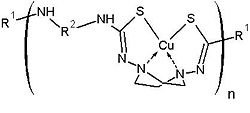
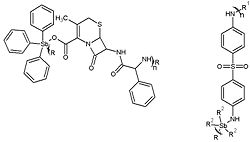
Organocuprados han servido muy a menudo como alguicidas, fungicidas e insecticidas. Últimamente, pues, se avanzó en este concepto y se encontró que los complejos de tipo poli(tiosemicarbazida)cobre (II) como el que se muestra en la figura a continuación, son excelentes alguicidas y moluscicidas.
Por lo que al hierro se refiere, cabe destacar el gran interés que se está presentando en el estudio de drogas quelantes para poder eliminar el Fe excedente de algunos pacientes, que puede darse por un consumo excesivo de alimentos ricos en Fe, o bien por defectos en la excreción del mismo, ya sea por problemas metabólicos o simplemente fisiológicos. Esta dificultad para eliminar el hierro del cuerpo se denomina β-talasemia, conocida también como anemia de Cooley. La anemia de Cooley es un desorden genético muy raro en los EEUU, pero bastante extendido por la región Mediterránea, Oriente Próximo, India y Sureste Asiático. Se caracteriza por la incapacidad de sintetizar cantidades idóneas de la cadena β de la hemoglobina. Dado que un exceso de cadenas α forma tetrámeros insolubles, estos precipitan en los eritrocitos, causando su muerte, y consecuentemente, la anemia. Existen agentes quelantes del hierro de origen natural, como por ejemplo la desferroxiamina B (DFO), enterobatino y ferricromo, que quelan el Fe con heteroátomos que suelen ser O ó N. Dada la baja toxicidad y alta habilidad quelante de la DFO, actualmente, esta sustancia está disponible bajo el nombre comercial de “Desferal”. DFO es eficaz y además tiene una duración corta en el plasma sanguíneo antes de ser eliminado. El polímero que a continuación se enseña, encierra los átomos de hierro, quelándolos y facilitando así su eliminación.
6.1.4. Polímeros de condensación.
Estudios recientes demuestran la actividad de oligómeros de organogermanio en la inhibición del crecimiento de tumores en dosis determinadas:
También, varios polímeros de antimonio fueron sintetizados y demostrados como potentes bactericidas, algunos de los cuales se muestran a continuación:
6.2. Moléculas discretas.
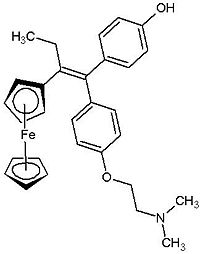
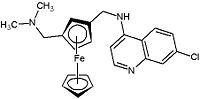
La lucha contra el cáncer se extiende hoy en día a la investigación con compuestos organometálicos relativamente sencillos, de naturaleza no polimérica. La droga más empleada en la lucha oncológica es el tamoxifen. Esta droga suele tener una buena aceptación a nivel de compatibilidad con los pacientes, pero tiene serios efectos adversos: luego de un tratamiento duradero, puede desarrollarse resistencia y aumenta paradójicamente el riesgo de cáncer de útero, al tiempo que no es tan eficaz contra los tumores que no dependen de la regulación hormonal (un tercio de los cánceres conocidos). El principal mecanismo de acción del tamoxifen es bloquear o interferir la acción del estradiol. La droga metaboliza, formándose hidroxitamoxifen que se asemeja a un receptor de estrógenos, previniendo la llegada de esta hormona a la célula y por tanto, evitando su crecimiento. La razón de avance fundamental es la síntesis de una droga similar al tamoxifen, que salve sus efectos adversos, actuando de modo similar. Los primeros indicios se centraron en el dicloruro de titanoceno (Cp2TiCl2), pero éste, actuó como un estrógeno, incentivando el crecimiento del cáncer. Posteriormente, ferrocenos sustituidos, fusionados con el tamoxifen, ferrocifenos mostraron una eficacia digna de mención contra la proliferación de tumores y lo que aun es mejor, son eficaces con tumores dependientes e independientes de la regulación hormonal. La molécula que se presenta abajo (hidroxiferrocifeno) inhibe el crecimiento de las células cancerígenas del cáncer de riñón y además, es menos tóxico que el tamoxifen original.
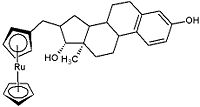
También se estudiaron grupos análogos con Ru, W ý Co con 17-estradiol. Estas hormonas mostraron una excelente afinidad hacia la inhibición del crecimiento de los tumores mediante el mecanismo de acción que el tamoxifen. A continuación se expone un ejemplo:
Los compuestos organometálicos también dieron resultados satisfactorios en investigaciones que pretendían eliminar al Plasmodium falciparum, el parásito que provoca la malaria. Hoy en día, existen medicinas, como la cloroquina que inhibe el crecimiento del parásito, pero se sospecha que éste pueda crear resistencia. Dado que el parásito necesita sangre para poder vivir, la estrategia fue combinar la cloroquina con ferroceno, que contiene el hierro necesario para producir hemoglobina. Este compuesto, llamado ferroquina es mucho más eficaz que la cloroquina y no permite el desarrollo de resistencia.
Varios compuestos medio-sándwich son objeto de estudio por su eficacia en la industria radiofarmacéutica.
El LiCO3 es una droga muy utilizada en el tratamiento de trastornos bipolares. El rango de concentraciones de litio en sangre que permiten tal utilidad sin llegar a causar otros desórdenes es muy estrecho, por lo que se requiere una monitorización estricta y una recaptación del ión Li+. En la imagen de la izquierda, se expone un receptor eficaz y selectivo que atrae el litio por medio de enlaces con los oxígenos.
Error en la cita: Error en la cita: existe un código de apertura <ref> sin su código de cierre </ref>
Wikimedia foundation. 2010.