- Malaria
-
Malaria 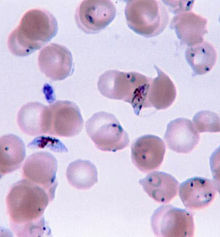
Trofozoítos (formas anulares) y gametocitos de Plasmodium falciparum en sangre humana.Clasificación y recursos externos CIE-10 B50 CIE-9 084 OMIM 248310 DiseasesDB 7728 MedlinePlus Información de salud en la enciclopedia MedlinePlus eMedicine med/1385 emerg/305 ped/1357 MeSH C03.752.250.552 Sinónimos - Paludismo
- Fiebre de la Jungla
- Ague
 Aviso médico
Aviso médico La malaria es una enfermedad producida por parásitos del género Plasmodium, que es probable que se haya transmitido al ser humano por los gorilas occidentales.[1] Es la primera en importancia de entre las enfermedades debilitantes, con más de 210 millones de casos cada año en todo el mundo.
El término malaria proviene del italiano medieval mala aria (mal aire); en español se le llama también paludismo, del latín palus, «pantano».
El día africano de lucha contra el paludismo se celebra el 25 de abril,[2] ya que es en este continente donde más común es esta enfermedad.
La enfermedad puede ser causada por una o varias de las diferentes especies de Plasmodium: Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale o Plasmodium knowlesi, siendo las tres primeras reportadas en el continente americano. Los vectores de esta enfermedad son diversas especies del género Anopheles. Como es sabido, tan sólo las hembras de mosquitos son las que se alimentan de sangre para poder madurar los huevos, y por tanto los machos no pican y no pueden transmitir enfermedades ya que únicamente se alimentan de néctares y jugos vegetales.
La única forma posible de contagio directo entre humanos es que una mujer embarazada lo transmita por vía trasplacentaria al feto. O bien, por la transmisión directa a través de la picadura de un mosquito. También es posible la transmisión por transfusiones sanguíneas de donantes que han padecido la enfermedad.
En regiones donde la malaria es altamente endémica, las personas son tan a menudo infectadas que desarrollan la "inmunidad adquirida", es decir que son portadores más o menos asintomáticos del parásito.
1,3 millones de personas mueren cada año de paludismo; de éstos, un 90% son niños menores de cinco años. Cada año se producen 396 millones de casos de paludismo. La mayor parte de la carga de morbilidad se registra en el África, al sur del Sahara.[4]
La primera vacuna fue desarrollada por el grupo de cientificos dirigido por el doctor Manuel Elkin Patarroyo, médico colombiano, y tenía una efectividad de entre un 40% y un 60% en adultos, y en niños un 77%.[cita requerida]
Contenido
Historia
La malaria ha infectado a los humanos durante más de 50.000 años, y puede que haya sido un patógeno humano durante la historia entera de nuestra especie.[3] De cierto, especies cercanas a los parásitos humanos de la malaria se han encontrado en los chimpancés, pariente ancestral de los humanos.[4] Se encuentran referencias de las peculiares fiebres periódicas de la malaria a lo largo de la historia, comenzando desde 2700 a. C. en China.[5] El término malaria proviene del italiano de la edad media: mala aria — "mal aire"; y se le llamó también paludismo, del latín "palus" (pantano).
Los estudios científicos sobre la malaria hicieron su primer avance de importancia en 1880, cuando el médico militar francés Charles Louis Alphonse Laveran, trabajando en Argelia, observó parásitos dentro de los glóbulos rojos de personas con malaria. Propuso por ello que la malaria la causaba un protozoario, la primera vez que se identificó a un protozoario como causante de una enfermedad.[6] Por este y otros descubrimientos subsecuentes, se le concedió el Premio Nobel en Fisiología o Medicina en 1907. Al protozoario en cuestión se le llamó Plasmodium, por los científicos italianos Ettore Marchiafava y Angelo Celli.[7] Un año después, Carlos Finlay, un médico cubano que trataba pacientes con fiebre amarilla en la Habana, sugirió que eran los mosquitos quienes transmitían la enfermedad de un humano a otro. Posteriormente, fue el británico Sir Ronald Ross, trabajando en la India, quien finalmente demostró en 1898 que la malaria era transmitida por los mosquitos. Lo probó al mostrar que ciertas especies del mosquito transmitían la malaria a pájaros y aislando los parásitos de las glándulas salivales de mosquitos que se alimentaban de aves infectadas.[8] Por su aporte investigador, Ross recibió el premio Nobel de Medicina en 1902. Después de renunciar al Servicio Médico de la India, Ross trabajó en la recién fundada Liverpool School of Tropical Medicine y dirigió los esfuerzos por controlar la malaria en Egipto, Panamá, Grecia y Mauricio.[9] Los hallazgos de Finlay y Ross fueron confirmados luego por un comité médico dirigido por Walter Reed en 1900, y sus recomendaciones implementadas por William C. Gorgas en medidas de salud adoptadas durante la construcción del Canal de Panamá. Este trabajo salvó la vida de miles de trabajadores y ayudó a desarrollar los métodos usados en campañas de salúd pública contra la malaria.
El primer tratamiento eficaz para la malaria fue la corteza del árbol Cinchona, que contiene el alcaloide quinina. Este árbol crece en las colinas de los Andes, en particular en Perú. Los habitantes del Perú usaban el producto natural para controlar la malaria, y los Jesuitas introdujeron esta práctica en Europa durante los años 1640, donde fue aceptada con rapidez.[10] Sin embargo, no fue sino hasta 1820 cuando la quinina, el ingrediente activo, fue extraída de la corteza y nombrada por los químicos franceses Pierre Joseph Pelletier y Jean Bienaime Caventou.[11]
A comienzos del siglo XX, antes de los antibióticos, los pacientes con sífilis eran intencionalmente infectados con malaria para crear una fiebre, siguiendo las investigaciones de Julius Wagner-Jauregg. Al controlar la fiebre con quinina, los efectos tanto de la sífilis como la malaria podían ser minimizados. Algunos de los pacientes murieron por la malaria, pero el riesgo era preferible por encima de la casi segura muerte por sífilis.[12]
A pesar de que en el estadio sanguíneo y en el mosquito del ciclo de vida de la malaria se estableció en el siglo XIX y a comienzos del siglo XX, solo en 1980 se observó la forma latente hepática del parásito. Este descubrimiento explicó finalmente por qué daba la impresión de que algunas personas se curaban de la enfermedad, para recaer años después de que el parásito hubiese desaparecido de su circulación sanguínea.[13] [14]
Síntomas
Los síntomas son muy variados, empezando con fiebre, escalofríos, sudoración y dolor de cabeza. Además se puede presentar náuseas, vómitos, tos, heces con sangre, dolores musculares, ictericia, defectos de la coagulación sanguínea, shock, insuficiencia renal o hepática, trastornos del sistema nervioso central y coma.[15] [16] [17]
La fiebre y los escalofríos son síntomas cíclicos, repitiéndose cada dos o tres días.[15] [16] [17]
Comparación de las características de las infecciones producidas por las especies de Plasmodium P. vivax P. falciparum P. malarie Duración del ciclo preeritrocítico 6 a 8 días 5 a 7 días 12 a 16 días Periodo prepatente 11 a 23 días 9 a 10 días 15 a 16 días Periodo de incubación 12 a 17 días 9 a 14 días 18 a 40 días Ciclo esquizogónico de los hematíes 48 horas 48 horas(irregular) 72 horas Parasitemia (promedio mm3) 20 000 20 000 a 500 000 6 000 Gravedad del ataque primario Benigno Grave en los no inmunes Benigno Duración de la crisis febril(en horas) 8 a 12 16 a 36 8 a 10 Recurrencias Medianas Nulas o escasas Abundantes Lapsos entre recurrencias Largos Cortos Muy largos Duración de la infección(en años) 2 a 3 1 a 2 3 a 50 Epidemiología
La malaria causa unos 400–900 millones de casos de fiebre y aproximadamente 2-3 millones de muertes anuales[18] , lo que representa una muerte cada 15 segundos. La gran mayoría de los casos ocurre en niños menores de 5 años;[19] las mujeres embarazadas son también especialmente vulnerables.[20] A pesar de los esfuerzos por reducir la transmisión e incrementar el tratamiento, ha habido muy poco cambio en las zonas que se encuentran en riesgo de la enfermedad desde 1992.[21] De hecho, si la prevalencia de la malaria continúa en su curso de permanente aumento, la tasa de mortalidad puede duplicarse en los próximos veinte años.[18] Las estadísticas precisas se desconocen porque muchos casos ocurren en áreas rurales, donde las personas no tienen acceso a hospitales o a recursos para garantizar cuidados de salud. Como consecuencia, la mayoría de los casos permanece indocumentada.[18]
Aunque la co-infección de VIH con malaria ha incrementado la mortalidad, sigue siendo un problema menor que la combinación de VIH-tuberculosis.[cita requerida]
Mecanismo de transmisión y ciclo biológico de Plasmodium
Archivo:Ciclo de vida Malaria.gifCiclo de la malaria Glóbulo rojo infectado por P. vivax
Glóbulo rojo infectado por P. vivax
La hembra del Anopheles infectada es portadora de los esporozoítos del Plasmodium en sus glándulas salivales. Si pica a una persona, los esporozoitos entran en la persona a través de la saliva del mosquito y migran al hígado, donde se multiplican rápidamente dentro de las células hepáticas (los hepatocitos) mediante una división asexual múltiple, y se transforman en merozoitos que entran en el torrente sanguíneo. Allí infectan los eritrocitos y siguen multiplicándose, dando lugar a unas formas iniciales típicamente anulares (trofozoítos), formas en división asexual múltiple (merontes) y finalmente un número variable de merozoítos según la especie de Plasmodium, que provoca la ruptura del eritrocito. Algunos merozoítos se transforman en unas células circulares relativamente grandes que son gametocitos femeninos y masculinos y dejan de multiplicarse, aunque en P. falciparum son más grandes que el propio eritrocito y tienen forma de boomerang, lo que ocasiona su ruptura. Una hembra de Anopheles no infectada pica a un enfermo y adquiere los gametocitos, y así se inicia el ciclo sexual del Plasmodium. Con la unión de los gametos en su intestino, la formación de un huevo, que es móvil, y que dará origen a un Ooquiste que volverá a dividirse y dar esporozoitos listos para infectar nuevamente, al llegar a las glándulas salivales del mosquito.
En los humanos, las manifestaciones clínicas se deben a:
La ruptura de glóbulos rojos, que liberan merozoitos, que liberan sustancias que estimulan el hipotálamo, ocasionando repentinas crisis febriles, muy intensas, cada dos o tres días (al completarse el ciclo eritrocitico o asexual de Plasmodium), seguidas al cabo de unas horas de una brusca vuelta a una aparente normalidad. Este proceso va dejando al organismo exhausto, y en el caso de los niños pequeños hay una gran probabilidad de un desenlace fatal en ausencia de tratamiento.
El parásito evita el sistema inmunitario al permanecer intracelularmente en los hepatocitos y eritrocitos, aunque muchos eritrocitos parasitados se eliminan en el bazo. Para evitarlo, el parásito produce ciertas proteínas que se expresan en la superficie del eritrocito y causan su adherencia al endotelio vascular, especialmente en Plasmodium falciparum: este es el factor principal de las complicaciones hemorrágicas de la malaria. Dichas proteínas son además altamente variables, y por lo tanto el sistema inmunitario no puede reconocerlas de forma efectiva, ya que cuando elabora un número de anticuerpos suficiente (al cabo de dos semanas o más), estos serán inútiles porque el antígeno ha cambiado.
El ciclo continúa cuando un mosquito ingiere sangre de un enfermo o portador, y con ello algunos gametocitos. En el intestino del mosquito estos se transforman en macrogametos (femenino) y microgametos (masculinos), que se fusionan dando un cigoto móvil u oocineto. Este finalmente formará los esporozoítos que migran a las glándulas salivares del mosquito, completando el ciclo vital.
Las mujeres gestantes son especialmente atractivas para los mosquitos y la malaria en ellas es especialmente nefasta, dada la sensibilidad del feto (que no tiene un sistema inmunitario desarrollado) a la infección.
Vacuna
Segun la Organizacion Mundial de la Salud, estos son los proyectos de vacunas contra la malaria:
Etapa pre-clinica
- P27A
- pfAMA1 DiCo
- PAM VAR2CSA
- Var2-CSA DBL2/3-X
- NMRC-M3V-Ad-Pf5
- CSVAC
- Pf CelTOS FMP012
- Ad35.CS.01/Ad26.CS.01 (Heterologous adenovirus prime-boost strategy)
- Vacuna pediatrica - dos componentes (CS)
- Pf GAP p52-/p32- (Esporozoitos atenuados geneticamente)
- MSP1 full length
- Pfs25-rEPA/Alhydrogel
- Pfs25-Pfs25 vacuna conjugada
- SR11.1
- Pf10C-MBP
- NMRC-M3V-Ad-PfCA con adyuvante (7DW8-5)
Etapa clínicaPreeritrocítica
- RTS,S/AS01E
- AdCh63/MVA ME-TRAP
- Adenovirus (Ad35) vectored CS
- PfSPZ: metabólicamente activa, vacuna esporozoítica no replicante
- polyepitope DNA EP1300
Blood-stage
- AdCh63/MVA MSP1
- EBA175 RII
- FMP2.1/AS02A (AMA-1 3D7 E. coli en adyuvante AS02A)
- FMP2.1/AS01B (AMA-1 3D7 E. coli en adyuvante ASO1B)
- FMP010/AS01B (MSP-1 42 FVO E. coli en adyuvante AS01B)
- GMZ2
- GMZ2 field
- MSP3 [181-276]
- MSP3 [181-276] field
- SE36
- JAIVAC (MSP1 19/EBA175)
- AMA1-C1/Alhydrogel®+ CPG 7909
- BSAM-2/Alhydrogel®+CPG 7909
- NMRC-M3V-Ad-PfCA
- NMRC-M3V-D/Ad- PfCA Prime/Boost
- CSP, AMA1 virosomas (PEV 301,302)
P. vivax
- VMP001/AS01B
Inactivas o descontinuadas- RTS,S/AS02A
- FMP011/AS01B (LSA-1 E. coli en adyuvante AS01B)
- FMP011/AS02A (LSA-1 E. coli en adyuvante AS02A)
- FP9/MVA Poliproteina
- FP9 CSP + LSA-1 epitope/ MVA-CSP + LSA-1 epitope
- DNA/MVA prime-boost Multi-Epitope (ME) string + TRAP
- FP9 MVA prime-boost ME-TRAP
- HepB Core-Ag CSP VLP
- RTS,S/AS02 y FMP1/AS02
- RTS,S/AS02 y SSP2/TRAP
- RTS,S/AS02 y MVA CSP
- RTS,S/AS02 y DNA CSP
- CSP inmunizacion DNA
- MuStDO5 (Multi-Stage DNA vaccine Operation, 5 antígenos)
- NMRC-MV-Ad-PfC
- CSP long synthetic peptide
- LSA-3 (inactiva)
- PfCP2.9 (MSP-1 19/AMA-1 chimera)
- GLURP [85-213]
- AMA1-FVO [25-545]
- AMA1-FVO [25-545] field
- FMP1/AS02A (MSP-1 42 3D7 E. coli en adyuvante AS02A)
- MSP1-C1/AlOH/AlOH + CpG
- MSP2-C1/ISA720
- AMA1-C1/ ISA720
- AMA-1 (Australia)
- RESA, MSP1, MSP2 (combinación B)
- Pfs25
- Pvs25
- PvRII
- Spf66
Las vacunas para la malaria están en desarrollo, no hay disponible todavía una vacuna completamente eficaz. Los primeros estudios prometedores que demuestran la posibilidad de una vacuna contra el paludismo se realizaron en 1967 por la inmunización de ratones con esporozoitos atenuados por radiación, que brindan protección a alrededor del 60% de los ratones posterior a la inyección con normal, viable esporozoitos. Desde la década de 1970, se ha producido un considerable esfuerzo para desarrollar estrategias de vacunación similares en los seres humanos.Se han realizado muchos trabajos para intentar comprender los procesos inmunológicos que brindan protección después de la inmunización con esporozoitos irradiados. Tras el estudio de vacunación en ratones en 1967, se formuló la hipótesis de que los esporozoitos inyectados eran reconocidos por el sistema inmune, que a su vez creaba anticuerpos contra el parásito. Se determinó que el sistema inmunológico estaba creando anticuerpos contra la proteína circumsporozoito (CSP) que reviste a los esporozoitos. Además, los anticuerpos contra la CSP impidieron que los esporozoitos invadiesen hepatocitos. CSP , por lo tanto, fue elegida como la proteína más prometedora para desarrollar una vacuna contra la malaria esporozoitos. Es por estas razones históricas que las vacunas basadas en CSP son las más numerosas de todas las vacunas contra la malaria. [cita requerida]
Actualmente, existe una gran variedad de vacunas sobre la mesa. Vacunas pre-eritrocíticas (vacunas que se dirigen a los parásitos antes de que llegue a la sangre), en particular las vacunas basadas en CSP, forman el mayor grupo de investigación de la vacuna contra la malaria. En la lista de vacunas candidatas se incluyen: las que tratan de inducir inmunidad en la etapa de infección de la sangre, las que tratan de evitar las patologías más severas de la malaria evitando la adhesión del parásito a las vénulas de la sangre y a la placenta; y las vacunas que bloqueen la transmisión que detendrían el desarrollo del parásito en el mosquito justo después de que el mosquito ha tomado sangre de una persona infectada. Es de esperar que la secuenciación del genoma de P. falciparum proporcionará objetivos para nuevos medicamentos o vacunas. [cita requerida]
Inmunización con plasmodios irradiados
Se determinó que una persona puede protegerse de una infección por P. falciparum si recibe picaduras de más de 1000 mosquitos infectados por irradación.[cita requerida]En general, se ha aceptado que no es adecuado tratar a las personas de riesgo con esta estrategia de vacunación, pero esto ha sido recientemente cuestionado por el trabajo que está realizando el doctor Stephen Hoffman, de Sanaria, uno de los principales investigadores que originalmente secuenció el genoma de Plasmodium Falciparum. Su trabajo más reciente ha girado en torno a la solución del problema de logística de la preparación y aislamiento de los parásitos equivalentes a 1000 mosquitos irradiados para el almacenamiento masivo y la inoculación de los seres humanos. La compañía ha recibido recientemente varias subvenciones multimillonarias de la Fundación Bill y Melinda Gates y el gobierno de los EE.UU. para iniciar los primeros estudios clínicos en 2007 y 2008. El Instituto de Investigación Biomédica de Seattle (SBRI), financiado por la Iniciativa Vacuna contra la Malaria asegura a los posibles voluntarios que "los ensayos clínicos no serán un riesgo para la vida. Si bien muchos voluntarios [en Seattle] realmente contraerán la enfermedad, la cepa clonada utilizada en los experimentos se puede curar, y no causa una forma recurrente de la enfermedad. "Algunos de los participantes obtendrá drogas experimentales o vacunas, mientras que otros recibirán placebo."
Vacunas SPf66
La primera vacuna desarrollada objeto de ensayos de campo fue la SPf66, desarrollada por Manuel Elkin Patarroyo en 1987, probada en una colonia de monos de la región amazónica, los Aotus trivirgatus. . Presenta una combinación de antígenos de los esporozoitos el científico colombiano (utilizando repetición CS) y merozoitos del parásito. Durante la fase I de los ensayos se demostró una tasa de eficacia del 75% y la vacuna pareció ser bien tolerada por el sistema inmunogénico de los sujetos. Los ensayos de las fases IIb y III fueron menos prometedores, la eficacia cayó hasta situarse entre el 38,8% y el 60,2%. Un ensayo llevado a cabo en Tanzania en 1993 demostró una eficacia del 31% después de un año de seguimiento. Sin embargo un estudio más reciente (aunque controvertido) realizado en Gambia no mostró ningún efecto. A pesar de los períodos de prueba relativamente largos y del número de estudios realizados, aún no se conoce la forma en que la vacuna SPf66 confiere inmunidad, por lo que sigue siendo una improbable solución a la malaria. El CSP fue la siguiente vacuna desarrollada que inicialmente parecía suficientemente prometedora como para someterse a los ensayos. También se basaba en las proteína circumsporozoito, pero además tenía la proteína recombinante (Asn-Ala-Pro15Asn-Val-Asp-Pro)2-Leu-Arg(R32LR) covalentemente a una toxina purificada Pseudónimas eruginosa (A9). Sin embargo en una fase temprana se demostró una falta total de inmunidad protectora en los inoculados. El grupo de estudio utilizado en Kenia tuvo un 82% de incidencia de parasitemia, mientras que el grupo de control sólo tuvo un 89% de incidencia. La vacuna tenía la intención de provocar un respuesta incrementada de linfocitos T en los que fueron expuestos, cosa que tampoco fue observada.
La vacuna se probó en más de 41.000 voluntarios en América Latina, donde a principios de 1994 fueron inoculados 45 voluntarios que demostraron que la vacuna induce una fuerte respuesta inmunitaria (entre un 40 y un 60% en los adultos, y hasta un 77% en los niños) contra la malaria, sin provocar efectos colaterales. Finalmente, luego de ser evaluada en Gambia, Tanzania y Tailandia, la vacuna demostró no tener la efectividad aspirada por el doctor Patarroyo, por lo cual se detuvo el proceso de fabricación y vacunación con la SPF66. A partir de este momento los laboratorios del Dr. Patarroyo se han dedicado a estudiar la vacuna con el objetivo de tener un 99.9% de efectividad en todos los casos. La SPF66 se convirtió en la vacuna más efectiva contra la malaria, hasta hoy desarrollada.[cita requerida]
La eficacia de la vacuna de Patarroyo fue puesta en duda por algunos científicos de EE.UU. que en 1997 concluyeron en la revista The Lancet que "la vacuna no es eficaz y debe suprimirse", mientras que el Colombiano les acusó de "arrogancia" y de que sus afirmaciones estaban motivadas por el hecho de que él provenía de un país en desarrollo. [cita requerida]
Vacuna RTS,S/AS02A
La vacuna RTS,S/AS02A está siendo desarrollado por una alianza entre la PATH Malaria Vaccine Initiative (un concesionario de la Fundación Gates), la empresa farmacéutica GlaxoSmithKline, y el Walter Reed Army Institute of Research.[103] En esta vacuna, una porción de CSP ha sido fundida con el "S antígeno" inmunogénico del virus de la hepatitis B; esta proteína recombinante se inyecta junto al potente adyuvante AS02A. [101] En octubre de 2004, los investigadores de la RTS,S/AS02A anunciaron los resultados de un ensayo de fase IIb, indicando que la vacuna redujo el riesgo de infección en aproximadamente un 30% y la gravedad de la infección en más de un 50%. El estudio examinó más de 2.000 niños de Mozambique. [104] Los ensayos más recientes de la vacuna RTS,S/AS02A se han centrado en la seguridad y eficacia de su administración en la primera etapa de la infancia: En octubre de 2007, los investigadores anunciaron los resultados de los ensayos de las fases I / IIb realizados sobre 214 lactantes Mozambiqueños de entre 10 y 18 meses, en los que la administración de tres dosis de vacuna llevó a un 62% de reducción de infecciones sin efectos secundarios graves salvo algo de dolor en el punto de inyección.[105] La investigación posterior demorará el lanzamiento comercial de esta vacuna hasta alrededor de 2012.[cita requerida]
La revista The Lancet publicó el 16 de octubre de 2004 los resultados iniciales del mayor ensayo clínico de una vacuna contra la malaria en África.
Otros métodos
La técnica de los insectos estériles se está perfilando como un posible método de control de mosquitos. El progreso hacia insectos transgénicos, o genéticamente modificados, sugieren que las poblaciones de mosquitos silvestres podrían hacerse resistentes a la malaria. La investigación en el Imperial College de Londres creó el primer mosquito transgénico para el paludismo, con la primera especie resistente a Plasmodium, anunciado por un equipo de la Case Western Reserve University en Ohio, en 2002. El éxito de la sustitución de las poblaciones existentes con poblaciones genéticamente modificadas, se basa en un mecanismo de transmisión, como los elementos trasladables para permitir la herencia mendeliana de los genes de interés. [cita requerida]
La educación en el reconocimiento de los síntomas de la malaria ha reducido el número de casos en algunas zonas del mundo en desarrollo hasta en un 20%. Reconocer la enfermedad en las primeras etapas también puede evitar que cause muertes. La educación también puede informar a la gente para cubrir más áreas de aguas estancadas. Por ejemplo, los tanques de agua son caldo de cultivo ideal para el parásito y el mosquito. Por lo tanto, una forma de reducir el riesgo de la transmisión entre las personas es eliminar los recipientes o tanques con agua estancada. Se trata de poner en la práctica en la mayoría en las zonas urbanas donde hay grandes centros de población y por lo tanto la transmisión sería más probable.
El 22 de diciembre de 2007, la publicación PLoS Patógenos encontró que los pepinos de mar bloquean la transmisión del parásito de la malaria, ya que producen lecitina, que retarda el crecimiento de los parásitos. [cita requerida]
Antes del DDT, la malaria se había erradicado o controlado también en varias zonas tropicales mediante la eliminación de la intoxicación o la cría de los mosquitos o de los hábitats acuáticos de las etapas de la larva, por ejemplo, o el llenado con aceite o arena en los lugares con agua estancada. Estos métodos han tenido poca aplicación en África durante más de medio siglo. [cita requerida]
Otra vía para detener la malaria en el tercer mundo que se ha utilizado extensamente en el pasado es la utilización de insecticidas, como las piretrinas o el DDT. Se prohibió el uso de este último por sus posibles efectos en la salud y en la fauna, pero un grupo de científicos cree que debería revisarse esta prohibición tan estricta.[22] Se considera ahora que un uso medido con fines sanitarios, distinto del uso masivo con fines económicos del que fue objeto en el pasado, es una buena opción para el control o erradicación de la malaria bajo condiciones muy controladas, limitándose al interior de las casas y tejados en las zonas donde esta enfermedad es endémica, según la OMS. Algunos grupos ambientalistas, como la Pesticide Action Network no están de acuerdo con esta medida.[23]
Prevención
- La intensificación de la irrigación, las presas y otros proyectos relacionados con el agua contribuyen de forma importante a la carga de morbilidad del paludismo.
- El mejoramiento de la gestión de los recursos hídricos reduce la transmisión del paludismo y de otras enfermedades de transmisión vectorial.[5]
Véase también
 Wikcionario tiene definiciones para paludismo.Wikcionario
Wikcionario tiene definiciones para paludismo.Wikcionario- DDT
- Enfermedades de origen hídrico
- Anemia falciforme
- Talasemia
Referencias
- ↑ Cf. A. R., «La malaria viene de los gorilas», elpais.com, 22-9-2010, consultado ídem.
- ↑ UNESCO | Education - Día africano de lucha contra el paludismo : un futuro sin paludismo, el tema del Día Africano del Paludismo de este año
- ↑ Joy D, Feng X, Mu J, et al (2003). «Early origin and recent expansion of Plasmodium falciparum.». Science 300 (5617): pp. 318-21. PMID 12690197. [1]
- ↑ Escalante A, Freeland D, Collins W, Lal A (1998). «The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome.». Proc Natl Acad Sci U S A 95 (14): pp. 8124-9. PMID 9653151. http://www.pnas.org/cgi/content/full/95/14/8124. [2]
- ↑ Cox F (2002). «History of human parasitology.». Clin Microbiol Rev 15 (4): pp. 595-612. PMID 12364371. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=12364371. [3]
- ↑ «Biography of Alphonse Laveran». The Nobel Foundation. Consultado el 15-06-2007. ] Nobel foundation. Accessed 25 Oct 2006
- ↑ «Ettore Marchiafava». Consultado el 15-06-2007.
- ↑ «Biography of Ronald Ross». The Nobel Foundation. Consultado el 15-06-2007.
- ↑ «Ross and the Discovery that Mosquitoes Transmit Malaria Parasites». CDC Malaria website. Consultado el 15-06-2007.
- ↑ Kaufman T, Rúveda E (2005). «The quest for quinine: those who won the battles and those who won the war.». Angew Chem Int Ed Engl 44 (6): pp. 854-85. PMID 15669029.
- ↑ Kyle R, Shampe M (1974). «Discoverers of quinine». JAMA 229 (4): pp. 462. PMID 4600403.
- ↑ Raju T (2006). «Hot brains: manipulating body heat to save the brain.». Pediatrics 117 (2): pp. e320-1. PMID 16452338. http://pediatrics.aappublications.org/cgi/content/full/117/2/e320.
- ↑ Krotoski W, Collins W, Bray R, et al (1982). «Demonstration of hypnozoites in sporozoite-transmitted Plasmodium vivax infection.». Am J Trop Med Hyg 31 (6): pp. 1291-3. PMID 6816080.
- ↑ Meis J, Verhave J, Jap P, Sinden R, Meuwissen J (1983). «Malaria parasites--discovery of the early liver form.». Nature 302 (5907): pp. 424-6. PMID 6339945.
- ↑ a b «La Medicina para el Viajero - Malaria». University of Virginia Health System. University of Virginia. Consultado el 19 de febrero de 2010.
- ↑ a b «Malaria». New York State Department of Health. Consultado el 19 de febrero de 2010.
- ↑ a b «Malaria o paludismo». Administración Nacional de Laboratorios e Institutos de Salud. Consultado el 19 de febrero de 2010.
- ↑ a b c Breman J (2001). «The ears of the hippopotamus: manifestations, determinants, and estimates of the malaria burden.». Am J Trop Med Hyg 64 (1-2 Suppl): pp. 1-11. PMID 11425172. http://www.ajtmh.org/cgi/reprint/64/1_suppl/1-c.
- ↑ Greenwood BM, Bojang K, Whitty CJ, Targett GA (2005). «Malaria». Lancet 365: pp. 1487-1498. PMID 15850634.
- ↑ Rodriguez-Morales AJ, Sanchez E, Vargas M, Piccolo C, Colina R, Arria M, Franco-Paredes C (2006). «Pregnancy outcomes associated with Plasmodium vivax malaria in northeastern Venezuela». Am J Trop Med Hyg 74: pp. 755-757. PMID 16687675.
- ↑ Hay S, Guerra C, Tatem A, Noor A, Snow R (2004). «The global distribution and population at risk of malaria: past, present, and future.». Lancet Infect Dis 4 (6): pp. 327-36. PMID 15172341.
- ↑ [Boseley] (30 de agosto). «Malaria fears over planned DDT ban». The Guardian. Consultado el 27 de julio de 2008.
- ↑ [Boseley] (16 de septiembre de 2006). «Banned pesticide backed for malaria control» (artículo periodístico). The Guardian. Consultado el 27 de julio de 2008.
Bibliografía
- Rodríguez Ocaña E, Ballester Añón R, Perdiguero E, Medina Doménech RM, Molero Mesa J. (2003) La acción médico-social contra el paludismo en la España metropolitana y colonial del siglo XX. Madrid: Consejo Superior de Investigaciones Científicas.
- Cueto, Marcos (2007). Cold war, deadly fevers : malaria eradication in Mexico, 1955-1975 / Marcos . Washington, D.C. : Woodrow Wilson Center Press ; Baltimore : Johns Hopkins University Press, c2007.
Enlaces externos
- En español
- Malaria, en MedlinePlus
- «En el corazón de la malaria», Documento de elmundo.es.
- Symptoms of Malaria
- síntomas de la malaria
- En inglés
- Malaria en la Organización Mundial de la Salud -WHO-
- Por primera vez una vacuna ha protegido un gran numero de niños contra la malaria. http://www.washingtonpost.com/national/health-science/experimental-malaria-vaccine-protects-many-children-study-shows/2011/10/17/gIQA5NyguL_story.html
- Artículos de prensa en español
Categorías:- Enfermedades parasitarias
- Zoonosis
Wikimedia foundation. 2010.
