- Carbocatión
-
Carbocatión
Un carbocatión es un átomo de carbono cargado positivamente. El átomo de carbono cargado en un carbocatión es un "sexteto", esto es, tiene sólo seis electrones en su capa de valencia, en vez de los ocho electrones de valencia que aseguran la estabilidad máxima de la regla del octeto. De ahí que los carbocationes sean frecuentemente muy reactivos, pues buscan completar el octeto de electrones de valencia, así como volver a conseguir una carga eléctrica neutra. Se podría asumir que un carbocatión tiene hibridación sp3 con un orbital sp3 dando la carga positiva. Sin embargo, la geometría y reactividad del carbocatión es más consecuente con una hibridación sp2.
Contenido
Definiciones
Un carbocatión era llamado generalmente con anterioridad como un ion carbonio, pero surgieron interrogantes respecto a la semántica de dicho término.[1] En el presente, un carbocatión es cualquier átomo con carga positiva. Se han sugerido dos tipos especiales: ion carbenio, que es trivalente, y el ion carbonio, que es pentavalente o hexavalente. Los libros de texto universitarios sólo discuten a los carbocationes como si fueran iones carbenio,[2] o discuten a los carbocationes con fugaces referencias al anterior significado de ion carbonio[3] o iones carbenio o carbonio.[4] Un libro de texto adhiere el viejo significado de carbonio al ion carbenio y reserva la frase ion carbenio hipervalente para el CH5+.[5]
Historia
La historia de los carbocationes se remonta a 1891, cuando G. Merling[6] reportó que agregó bromo a tropilideno y calentó el producto para obtener un material cristalino, soluble en agua, C7H7Br. No sugirió una estructura; sin embargo Doering y Knox[7] mostraron convincentemente que era bromuro de tropilio (cicloheptatrienilio). Este ion estaba predicho como aromático por la regla de Hückel.
En 1902, Norris y Kehrman descubrieron independientemente que el trifenilmetanol incoloro producía soluciones de un profundo color amarillo en ácido sulfúrico concentrado. Del mismo modo, el cloruro de trifenilmetilo formaba complejos anaranjados con cloruros de aluminio y estaño. En 1902, Adolf von Baeyer reconoció el carácter salino de los compuestos formados.
- Ph3C—OH + H2SO4 → Ph3C+HSO4− + H2O (Ph : sustituyente arilo)
Los carbocationes son intermediarios reactivos en muchas reacciones orgánicas. Esta idea, propuesta por primera vez por Julius Stiegliz en 1899 (On the Constitution of the Salts of Imido-Ethers and other Carbimide Derivatives; Am. Chem. J. 21, 101; ISSN: 0096-4085) fue desarrollada posteriormente por Hans Meerwein en su estudio de 1922[8] del rearreglo de Wagner-Meerwein. Se encontró que los carbocationes también estaban involucrados en la reacción SN1 y la reacción E1, y en reacciones de rearreglo tales como el corrimiento 1,3 de Whitmore. El ambiente químico era reacio a aceptar la noción de un carbocatión y, por un largo tiempo, el Journal de la American Chemical Society rechazó artículos que los mencionaban.
EL primer espectro NMR de un carbocatión estable en solución fue publicado por Doering y co.[9] Era el ion heptametilbencenonio, preparado al tratar hexametilbenceno con cloruro de metilo y cloruro de aluminio. El catión estable 7-norbornadienilo fue preparado por Story y co.[10] al hacer reaccionar cloruro de norbornadienilo con tetrafluoroborato de plata en dióxido de azufre a -80°C. El espectro NMR estableció que estaba puenteado de una forma no clásica (el primer ion no clásico estable observado).
En 1962, Olah observó directamente el carbocatión resonancia magnética nuclear como una especie estable al disolver fluoruro de tert-butilo en ácido mágico. El NMR del catión norbornilo fue reportado por Schleyer y co.[11] y se encontró que sufría "proton scrambling" superando una barrera por Saunders y co.[12]
Propiedades
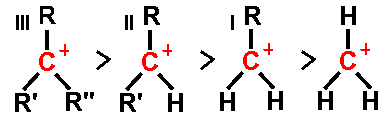 Orden de estabilidad de ejemplos de carbocationes de alquilo
Orden de estabilidad de ejemplos de carbocationes de alquilo
terciaros ( III ), secundarios ( II ), y primarios ( I )En química orgánica, un carbocatión suele ser el objetivo del ataque de un nucleófilo, como los iones OH- o iones de halógeno.
Los carbocationes se clasifican en primarios, secundarios, o terciarios, dependindo del número de átomos de carbono unidos al carbono ionizado. Los carbocationes primarios tienen cero o un átomo de carbono unido al carbono ionizado, los carbocationes secundarios tienen dos átomos de carbono unidos al carbono ionizado, y los carbocationes terciarios tienen tres átomos de carbono unidos al carbono ionizado.
La estabilidad de los carbocationes se incrementa con el número de grupos alquilo unidos al átomo de carbono que lleva la carga. Los carbocationes terciarios son más estables (y se forman más rápidamente) que los carbocationes secundarios; los carbocationes primarios son altamente inestable porque, mientras los carbocationes de orden mayor están estabilizados por hiperconjugación y por impedimento estérico, los carbocationes primarios no lo están. En consecuencia, reacciones como la reacción de eliminación E1 normalmente no ocurren si involucrasen a un carbocatión primario. Una excepción a esto ocurre cuando hay un enlace doble carbono-carbono en la posición 2 respecto al átomo de carbono ionizado. Tales cationes, como el catión alilo CH2=CH-CH2+ y el catión bencilo C6H5-CH2+ son más estables que los otros carbocationes. Las moléculas que pueden formar carbocationes alilo o bencilo son altamente reactivas.
Los carbocationes sufren reacciones de reordenamiento de estructuras menos estables a estructuras igualmente estables o más estables con constante de velocidad mayor a 1.0E9 s-1. Este hecho complica las trayectorias de síntesis de muchos compuestos. Por ejemplo, cuando el 3-pentanol se caliente con HCl acuoso, el carbocatión 3-pentilo formado se rearregla a una mezcla estadística de 3-pentil y 2-pentil. Estos cationes reaccionan con ion cloruro para producir cerca de 1/3 de 3-cloropentano y 2/3 de 2-cloropetano.
Algunos carbocationes como el catión norbornilo exhiben enlaces de tres centro más o menos simétricos. Los cationes de este tipo suelen ser conocidos como iones no clásicos. La diferencia de energía entres los carbocationes "clásicos" y los isómeros "no clásicos" suele ser muy pequeña, y si hay energía de activación involucrada en la transición entre estructuras clásicas y no clásicas ésta es pequeña. La forma "no clásica" del carbocatión 2-butilo es esencialmente 2-buteno, con un protón directamente sobre el centro de lo que sería el enlace doble carbono-carbono. Los carbocationes "no clásicos" fueron motivo de gran controversia. Una de las principales contribuciones de George Olah a la química fue la resolución de esta controversia.[13]
Referencias
- ↑ Gold Book definition Link
- ↑ Organic chemistry 5th Ed. John McMurry ISBN 0-534-37617-7
- ↑ Organic Chemistry, Fourth Edition Paula Yurkanis Bruice ISBN 0-13-140748-1
- ↑ Organic Chemistry Jonathan Clayden, Nick Geeves, Stuart Warren First Edition ISBN 0-19-850346-6
- ↑ Organic Chemistry by Marye Anne Fox and James K. Whitesell ISBN 0-7637-0413-X
- ↑ Chem. Ber. 24, 3108 1891
- ↑ The Cycloheptatrienylium (Tropylium) Ion W. Von E.Doering and L. H. Knox J. Am. Chem. Soc.; 1954; 76(12) pp 3203 - 3206; DOI 10.1021/ja01641a027
- ↑ H. Meerwein and K. van Emster, Berichte, 1922, 55, 2500.
- ↑ The 1,1,2,3,4,5,6-heptamethylbenzenonium ion W. von E. Doering and M. Saunders H. G. Boyton, H. W. Earhart, E. F. Wadley and W. R. Edwards G. Laber Tetrahedron Volume 4, Issues 1-2 , 1958, Pages 178-185 DOI 10.1016/0040-4020(58)88016-3
- ↑ The 7-norbornadienyl carbonium ion Paul R. Story and Martin Saunders J. Am. Chem. Soc.; 1960; 82(23) pp 6199 - 6199; DOI 10.1021/ja01508a058
- ↑ Stable Carbonium Ions. X.1 Direct Nuclear Magnetic Resonance Observation of the 2-Norbornyl Cation Paul von R. Schleyer, William E. Watts, Raymond C. Fort, Melvin B. Comisarow, and George A. Olah J. Am. Chem. Soc.; 1964; 86(24) pp 5679 - 5680; DOI 10.1021/ja01078a056
- ↑ Stable Carbonium Ions. XI.1 The Rate of Hydride Shifts in the 2-Norbornyl Cation Martin Saunders, Paul von R. Schleyer, and George A. Olah J. Am. Chem. Soc.; 1964; 86(24) pp 5680 - 5681; DOI 10.1021/ja01078a057
- ↑ George A. Olah - Nobel Lecture
Categorías: Química orgánica | Cationes
Wikimedia foundation. 2010.

