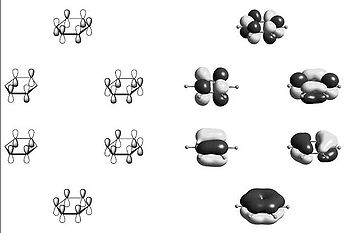- Regla de Hückel
-
Regla de Hückel
La regla de Hückel es una norma que permite saber rápidamente si una molécula cíclica es aromática. Una molécula es capaz de combinar los orbitales atómicos restantes que quedan sin enlazarse con otros átomos y crear orbitales moleculares que estabilicen la molécula. Un ejemplo es el butadieno:
El butadieno
Archivo:Butadieno.jpgEl butadieno tiene cuatro carbonos, los cuales se enlazan con enlaces dobles a pares. Como podemos observar, los carbonos adoptan una hibridación sp², lo que da lugar a una disposición planotrigonal de los tres orbitales híbridos y un orbital atómico p libre. Los orbitales híbridos de los carbonos se enlazan con otros carbonos y hidrógenos, poniendo tres electrones de los cuatro que tiene de valencia, uno en cada orbital híbrido, por tal de enlazarse con otro orbital del otro átomo (que también aportará un electrón) y formar un enlace σ con dos electrones. Al final, lo que nos queda es una molécula plana con orbitales σ para unir los átomos y cuatro orbitales p que quedan de los carbonos, y que son paralelos entre ellos. Cada uno de ellos tiene el electrón restante de los de valencia:
Siguiendo estricamente la estructura de Lewis del principio y usando la teoría del orbital molecular, entre el primer carbono y el segundo se formaría un enlace π, y lo mismo pasaría entre el tercero y el cuarto. Aún así, la molécula tiende a estabilizarse más, y en vez de combinar los orbitales p libres dos a dos, los combina los cuatro de golpe, formando un gran orbital π que engloba a los cuatro carbonos y que deslocaliza los electrones de los orbitales p. De esta forma se pueden explicar varias cosas:
- - La deslocalización de los electrones del doble enlace:
- - La parecida longitud de enlace entre todos los carbonos.
Moléculas aromáticas y antiaromáticas
Paralelamente al caso del butadieno, una molécula aromática es aquella que cumple los siguientes requisitos:
- -Es una molécula cíclica.
- -Es una molécula plana. Eso implica que todos los átomos que forman parte del anillo tengan hibridación sp².
- -Se pueden deslocalizar los electrones, es decir, se puede formar ese macroorbital π, y cumplen la regla de Hückel.
En conclusión, la REGLA DE HÜCKEL es la siguiente:
La regla de Hückel nos dice que después de haber corroborado los tres requisitos anteriores, una molécula es aromática si cumple que tiene 4n+2 electrones deslocalizados, y será antiaromática si cumple que tiene 4n electrones deslocalizados.
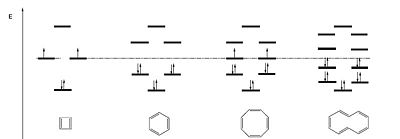
¿A qué se debe esta regla? Ésta sale a partir de los orbitales resultantes que salen de combinar n orbitales atómicos. Como dice la teoría del orbital molecular, el resultado de combinar n orbitales atómicos es n orbitales moleculares de diferente energía. Como cada carbono tendrá un electrón en su orbital p libre, de n orbitales moleculares tendremos n electrones deslocalizados. Y como en cada orbital molecular caben 2 electrones en espín opuesto, se llenan n/2 orbitales moleculares. Resulta ser que si el nº de electrones es 4n, los electrones llegan a un estado energético un poco superior al anterior, y por esa razón evitan deslocalizarlos por diferentes sistemas: localizando electrones, evitando ser planos, etc. En cambio, si resulta que el nº de electrones es 4n+2, los electrones se quedan en un estado energético mucho más bajo y se estabilizan más.
En este caso vemos como, por ejemplo, el de la izquierda, el ciclobutadieno, es antiaromático. Por esa razón esta molécula tiende a localizar los dobles enlaces. Y en el caso de la tercera molécula también es antiaromática, y por eso esta molécula tiende a salir del plano. La otras dos moléculas son aromáticas.
El caso típico de aromaticidad, y el más corriente y abundante en la naturaleza, es la molécula de benceno. Es una molécula que es fácil de ver sus niveles de energías, según los nodos que presenten las combinaciones de orbitales moleculares. El estado energético lo presenta sin ningún nodo, el siguiente encontramos dos estados degenerados con un nodo, etc.
Categorías: Química cuántica | Química orgánica
Wikimedia foundation. 2010.