- Caseína
-
Caseína
La caseína (del latín caseus, "queso") es una fosfoproteína (un tipo de heteroproteína) presente en la leche y en algunos de sus derivados (productos fermentados como el yogur o el queso). En la leche, se encuentra en la fase soluble asociada al calcio (fosfato de calcio) en un complejo que se ha denominado caseinógeno. La tabla 1 recoge el contenido de esta proteína en la leche de distintas especies de mamíferos.
Tabla 1. Contenido proteico y caseínico de la leche de algunas especies animales.[1] ,[2] ,[3] ,[4] ,[5] componente especie humana bovina ovina caprina proteínas (% del total lácteo) 1,3-1,5 3,2-3,5 5,4-6,0 3,1-4,0 caseínas (% del total proteico) 44,9 82,5 84,8 81,3
De los datos de dicha tabla se deduce que la leche de la especie humana no sólo contiene menor proporción de proteínas, sino que además, contiene menos cantidad de caseínas que las restantes especies.Contenido
Características de las caseínas
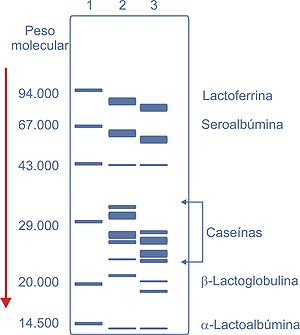 Figura 1. Patrón de electroforésis que se obtiene con las proteínas lácteas procedentes de las especies humana (calle 2) y bovina (calle 3). La calle 1 muestra las proteínas de referencia para los pesos moleculares y la flecha indica el sentido de migración de las proteínas. Se ha elaborado a partir de datos de diversas fuentes bibliográficas.[6] ,[7] ,[8]
Figura 1. Patrón de electroforésis que se obtiene con las proteínas lácteas procedentes de las especies humana (calle 2) y bovina (calle 3). La calle 1 muestra las proteínas de referencia para los pesos moleculares y la flecha indica el sentido de migración de las proteínas. Se ha elaborado a partir de datos de diversas fuentes bibliográficas.[6] ,[7] ,[8]
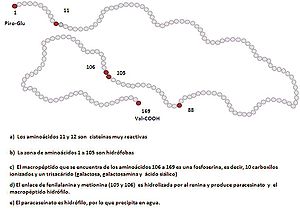 Figura 2. Estructura primaria de la κ-caseína bovina.[9]
Figura 2. Estructura primaria de la κ-caseína bovina.[9]
Las caseínas es un conjunto heterogéneo de proteínas por lo que es difícil fijar una definición. Sin embargo, todas las proteínas englobadas en lo que se denomina caseína tienen una característica común: precipitan cuando se acidifica la leche a pH 4,6. Por ello, a la caseína también se le suele denominar proteína insoluble de la leche. Por otra parte, y aunque las proteínas que se denominan caseínas son específicas de cada especie, se clasifican en los siguientes grandes grupos de acuerdo con su movilidad electroforética: αs1-caseína, αs2-caseína, β-caseína y κ-caseína (véase la Figura 1). Esta última es de especial interés en la industria quesera, ya que su hidrólisis enzimática por el cuajo (la enzima quimosina) genera una nueva proteína, denominada para-κ-caseína. Cuando esta última reacciona con el calcio genera paracaseinato de calcio. Durante el proceso de maduración del queso, y a partir de la para-κ-caseína, se forman unos macropéptidos denominados γ-caseínas, responsables de las características reológicas y organolépticas de los quesos.
Química y física de las caseínas
A diferencia de muchas otras proteínas, incluso de la leche, las caseínas no precipita por acción del calor. Por el contrario, precipita por la acción de una enzima proteasa presente en el estómago de los mamíferos llamada renina y forma un precipitado denominado paracaseína. Si la precipitación se realiza por la acción de ácidos, se le llama caseína ácida. En la elaboración de los quesos tienen lugar ambos tipos de precipitaciones.
Cuando se emplea la enzima tripsina, la caseína se hidroliza a una molécula fosfatada llamado peptona.
Las características de las caseínas de la leche de vaca se resumen en la tabla 2. La secuencia aminoacídica (ver Figura 2) de la caseína contiene un número inusual de residuos del aminoácido prolina: entre 10 en la αs2-caseína y 35 en la β-caseína. Como resultado, las caseínas son relativamente hidrofóbicas (poco soluble en agua) y carecen de estructura secundaria o terciaria bien definidas. En la leche se encuentra como suspensión de partículas que asemeja a las micelas de surfactantes (pequeñas esferas hidrofílicas en el exterior e hidrófobicas en el interior). Estas micelas de caseína se estabilizan por iones de calcio e interacciones hidrofóbicas.
Otro dato interesante, utilizado para separar las caseínas del resto de las proteínas lácteas mediante su precipitación, es que su punto isoeléctrico (pI) promedio es de 4,6. A este pH, las caseínas se encuentra en su punto de menor solubilidad debido a la reducción de las repulsiones intermoleculares, por lo que precipitan (vulgarmente se dice que coagulan). Ahora bien, el pI es diferente para cada una de las fracciones caseínicas, ya que varía entre el 4,44-4.97 para la αs1-caseína y el 5,3-5,8 en la variante genética B de la κ-caseína.
Tabla 2. Algunas de las características fisicoquímicas de las caseínas bovinas.[6] ,[10] Característica caseína αs1 αs2 β κ Concentración en leche (g/L) 12-15 3-4 9-11 2-4 Variantes genéticas B y C A A1 y A2 A y B Masa molecular 23.545 - 23.615 25.226 23.983 - 24.023 19.006 - 19.037 Punto isoeléctrico (pI) 4,44 - 4,76 ... 4,83 - 5,07 5,45 - 5,77 Restos de aminoácidos (nº) 199 207 209 169 Estructura micelar de las caseínas
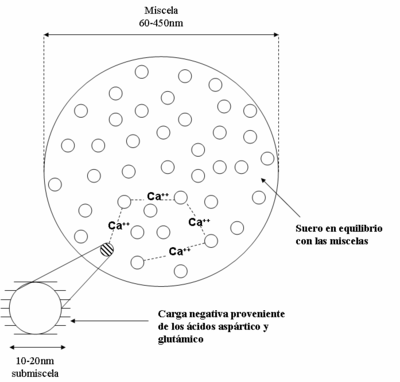
Las caseínas interaccionan entre sí formando una dispersión coloidal que consiste en partículas esféricas llamadas micelas (ver Figura 3) con un diámetro que suele variar entre 60 a 450nm poseyendo un promedio de 130nm. A pesar de la abundante literatura científica sobre la posible estructura de una micela, no hay consenso sobre el tema.
Se han propuesto diversos modelos fisicoquímicos de organización de las micelas, en los que estas se encuentran a su vez constituidas por subunidades (submicelas), con un diámetro de entre 10 y 20nm (véase la Figura 4). En tales modelos se considera que las subunidades se enlazan entre sí gracias a los iones de calcio. Se sugiere que el fosfato de calcio se une a los grupos NH2- de la lisina; el calcio interacciona con el grupo carboxilo ionizado (COO-). Las submicelas se constituyen a partir de la interacción constante entre las caseínas α, β y κ. Hay que resaltar la función de la κ-caseína para estabilizar las micelas,[11] especialmente contra la precipitación de las otras fracciones proteínicas por la acción del calcio o de los enzimas.[12] En todos estos se establece que las unidades hidrófobas entre las moléculas de proteínas aseguran la estabilidad de la micela.
Usos y aplicaciones
Además de usarse directamente en la elaboración de productos alimentarios (derivados lácteos y cárnicos, panes y productos de repostería, etc.), la caseína se utiliza en la elaboración de productos no alimentarios: pegamentos y pinturas, cubiertas protectoras, plásticos (véase la tabla 3).
Otros usos tecnológicos son la clarificación de vinos o como ingrediente en preparados de biología molecular y microbiología (medios enriquecidos para el cultivo microbiano).
En la alimentación especial, la caseína sirve para la elaboración de preparados médicos y concentrados proteicos destinados a la alimentación de los deportistas, especialmente después de su entrenamiento. Así, se ha observado que la digestión de las caseínas es más lenta que la de las lactoproteínas solubles (también denominadas seroproteínas) y, por ello, más apropiada para reparar el anabolismo de los aminoácidos durante el período que sigue a una comida.[13]
Tabla 3. Algunos usos tecnológicos de la caseína.[14] Producto Propiedad Aplicación Envoltura - Capacidad de formar películas
- Adherencia
- Pintura
- Tinta
- Papel
- Embalaje
- Acabado del cuero
- Envoltura textil
Adhesivo - Manejabilidad
- Fuerza de adhesión
- Resistencia al agua
- Cola con base acuosa
Plástico - Buen procesado
- Resistencia mecánica
- Resistencia al agua
- Plástico rígido
- Plástico desechable
- Fibra
- Película/ lámina de envoltura en embalajes
Surfactante - Tensión superficial
- Estabilidad de interface
- Emulgente, detergente
Referencias
- ↑ Jenness J. 1980. Composition and characteristics of goat milk: Review 1968-1979. Journal of Dairy Science 63(10): 1605-1630.
- ↑ Lonnerdal B y Forsum E. 1985. Casein content of human milk. American Journal of Clinical Nutrition 41(1): 113-120.
- ↑ Ribadeau-Dumas B y Grappin R. 1989. Milk protein analysis. Le Lait 69(5): 357-416.
- ↑ Park YW, Juárez M, Ramos M y Haenlein GFW. 2007. Physico-chemical characteristics of goat and sheep milk. Small Ruminant Research 68(1-2): 88–113.
- ↑ Willamson MB. 1944. The amino acid composition of human milk proteins. Journal of Biological Chemistry 156(1): 47 - 52.
- ↑ a b Farrell HM, Jimenez-Flores R, Bleck GT, Brown EM, Butler JE, Creamer LK, Hicks CL, Hollar CM, Ng-Kwai-Hang KF y Swaisgood HE. 2004. Nomenclature of the Proteins of Cows’ Milk—Sixth Revision. Journal of Dairy Science '87'(6): 1641-1674.
- ↑ Kunz C y Lonnerdal B. 1989. Human milk proteins: separation of whey proteins and their analysis by polyacrylamide gel electrophoresis, fast protein liquid chromatography (FPLC) gel filtration, and anion-exchange chromatography. American Journal of Clinical Nutrition 49(3): 464-470.
- ↑ Van Hekken DL y Thompson MP. 1992. Application of PhastSystem® to the resolution of bovine milk proteins on urea-polyacrylamide gel electrophoresis. Journal of Dairy Science '75'(5): 1204-1210.
- ↑ Mercier JC, Brignon G, Ribadeau-Dumas B. 1973. Structure primaire de la caséine-κ B bovine. European Journal of Biochemistry 35(2): 222-235.
- ↑ Swaisgoo HE. 1993. Review and update of casein chemistry. Journal of Dairy Science 76(10): 3054-3061.
- ↑ Pepper L y Farrell HM. 1982. Interactions leading to formation of casein submicelles. Journal of Dairy Science 65(12): 2259-2266.
- ↑ McMahon DJ y Brown RJ. 1984. Enzymic coagulation of casein micelles: A review. Journal of Dairy Science 67(5): 919-929.
- ↑ Lacroix M, Bos C, Léonil J, Airinei G, Luengo C, Daré S, Benamouzig R, Fouillet H, Fauquant J, Tomé D y Gaudichon C. 2006. Compared with casein or total milk protein, digestion of milk soluble proteins is too rapid to sustain the anabolic postprandial amino acid requirement. American Journal of Clinical Nutrition 84 (5): 1070-1079.
- ↑ Audic JL, Chaufer B y Daufin G. 2003. Non-food applications of milk components and dairy co-products: A review . Le Lait 83(6): 417-438.
Bibliografía
- Alais C. 1985. Ciencia de la leche. Editorial Reverté, S.A. Barcelona. ISBN 84-291-1815-2
- Amiot J. 1991. Ciencia y tecnología de la leche. Editorial Acribia, S.A. Zaragoza. ISBN 84-200-0713-7
- Schlimme E. 2002. La leche y sus componentes Propiedades químicas y físicas. Editorial Acribia, S.A. Zaragoza. ISBN 978-84-200-0992-6
- Walstra P y Jenness R. 1987. Química y física lactológica. Editorial Acribia, S.A. Zaragoza. ISBN 978-84-200-0594-2
Categoría: Proteínas
Wikimedia foundation. 2010.