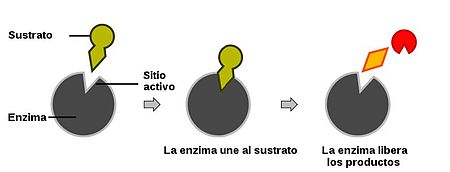
- Complejo enzima-sustrato
-
Algunas proteínas tienen la capacidad de modificar los ligandos a los cuales son unidos, es decir, actúan como catalizadores moleculares. Su función es acelerar en varios órdenes de magnitud el ajuste de un equilibrio de reacción químico, que en un proceso sin ellas podrían tardar una eternidad. Estas proteínas son las denominadas enzimas. Para realizar esta aceleración del proceso lo que consigue la enzima es lograr la disminución de la energía de activación de la reacción.
Las enzimas dirigen las transformaciones químicas y energéticas que tienen lugar en cada célula. Pero para realizar estas funciones básicas y vitales para nuestra vida deben tener una capacidad de interaccionar de forma específica y reversible con ligandos, que viene dada por su conformación espacial en el lugar de unión. Para que la enzima modifique el ligando (sustrato a partir de este momento) este debe “encajar” en el lugar de unión de la enzima. Por esto decimos que hay complementariedad geométrica entre enzima y sustrato.
Los lugares de unión acostumbran a estar en unas hendiduras de la superficie de la enzima, formando como un “bolsillo” en el cual entra el sustrato. De esta manera la superficie de interacción entre sustrato y enzima es mayor, y las posibilidades de conferir especificidad a la unión con el sustrato aumenta. La especificidad de la unión es tan alta que la enzima es capaz de distinguir entre sustratos esteroisómeros, por lo tanto decimos que las enzimas presentan esteroespecificidad. La esteroespecificidad puede servir en casos concretos para separar rutas de formación y degradación de productos, que se realizan de forma simultánea. Este hecho se debe a que las enzimas son moléculas asimétricas.
La unión se mantiene gracias a las fuerzas de enlaces no covalentes entre átomos del sustrato y la enzima, como enlaces de Van der Waals, enlace por puente de hidrógeno o puentes salinos, durante la catálisis, pero la unión es temporal, por tanto cuando la reacción enzimática finaliza se separan la enzima y el producto (ya no hablamos de sustrato después de la catálisis, ya que tiene una conformación modificada por la enzima).
Contenido
Centro Activo
El lugar de unión de un substrato a una enzima y donde se da la reacción de catálisis se denomina centro activo. En el centro activo encontramos restos de aminoácidos con sustituyentes funcionales para la catálisis de un sustrato. Al haber pero muchísimas variedades de reacciones que pueden ser catalizadas, no hay suficientes combinaciones de restos de aminoácidos como para ser cada catálisis específica para una de estas combinaciones, por tanto nuestras células utilizan las llamadas coenzimas. Las coenzimas acostumbran a ser complejas moléculas orgánicas, que sufren modificaciones durante la reacción enzimática para ayudar a la modificación final del sustrato. También pueden servir de donadoras o aceptoras de hidriones (H-) y electrones, o pueden transferir grupos funcionales. Tras la catálisis la coenzima vuelve a su estado original. Si la coenzima de queda unida de forma temporal a la enzima es llamada cosustrato. Si está anclada a la enzima, la llamamos grupo prostético.
Los centros activos de las enzimas pueden ser desnaturalizados, es decir, inactivada su especificidad de unión por la modificación de las proteínas de unión con el sustrato. La desnaturalización puede darse por una variación alta de la temperatura o del pH del ambiente donde se encuentre.
Distinguimos 2 tipos de hipótesis de uniones enzima-sustrato
Enlace llave-cerradura: El sustrato encaja perfectamente en el centro activo gracias a unas complementariedades moleculares y electrostáticas con la enzima de manera tal que este no cambia su forma. (El sustrato seria la llave y la enzima o centro activo la cerradura en este símil).
Enlace inducido: El sustrato NO encaja perfectamente en el centro activo de la enzima pero el centro activo cambia su conformación espacial provocando un ambiente favorable a la unión y reacción con el sustrato de manera que se une a este para proceder con la catálisis. En este caso no encontramos la misma especificidad como en el enlace de tipo llave-cerradura, por lo que la enzima puede reaccionar con varios sustratos de conformaciones parecidas.
Curva de Michaelis Menten
Para comprender mejor la unión entre sustrato y enzima analizaremos la curva de Michaelis-Menten. Es una curva de trayectoria hiperbólica en la que situamos en el inicio un complejo enzima-sustrato sin haberse unido y va dándose la unión del sustrato con el centro activo a medida que avanzamos en la curva, de manera que llegamos a una saturación de las enzimas por el sustrato formando un final asintótico en la curva. Esta saturación se debe a que encontramos más cantidad de sustrato que de enzimas, y llega un momento en que todas las enzimas están “ocupadas” realizando la catálisis de un sustrato, sin poder unirse a otro hasta terminar primero la reacción enzimática ya iniciada. El punto del eje Y donde se forma la asíntota al infinito es considerada la velocidad máxima de reacción de la enzima (de formación de producto).
Este proceso viene representado por la ecuación: E + S ⇌ [ES] → [EP] ⇌ E + P, donde E es la enzima, S es el sustrato, P el producto, y [ES] y [EP] son el complejo enzima-sustrato y enzima-producto respectivamente.
Análisis Energético del Complejo de Michaelis
El fin de todas las enzimas es reducir la energía libre de activación de las reacciones que catalizan. De esta manera se reduce el umbral energético a superar de la reacción, y hace esta mucho más rápida. Podemos afirmar que cuanta más alta es la energía de activación más lenta será la reacción pues el complejo enzima-sustrato será más inestable, y por tanto más difícil de conseguir.
Durante el estado [ES], complejo enzima-sustrato, vemos disminuida la entropía (AS) del sistema debido a un nivel más alto de organización, ya que al unirse por enlaces no covalentes el sustrato en el centro activo de la enzima pierde movilidad. Debido a que AS será negativo entonces, nos encontraremos con una energía libre más grande en este estado (AG = AH - TAS), lo que supondrá un estado menos favorable y por tanto más inestable.
Fuentes
EDICIONES REVERTÉ, WERNER MÜLLER-ESTERL, BIOQUÍMICA
Categoría:- Enzimas
Wikimedia foundation. 2010.