- Constante de disociación
-
La Constante de disociación o Kd es definida en termodinámica química como la relación matemática que se establece a partir de las concentraciones de los compuestos químicos que se forman en una reacción de disociación al alcanzar su punto de equilibrio.
Si un compuesto de formula Ax By se disocia según la reacción
la constante de disociación Kd se expresa mediante la siguiente relación de concentraciones (en moles por litro):
A menudo, la constante de disociación también se formula por pKd siendo
- pKd = -log(Kd).
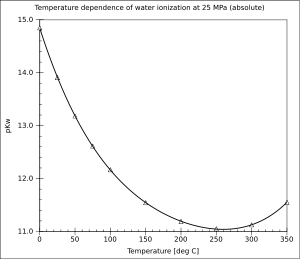
Constante de disociación del agua
Un ejemplo ilustrativo es el de la disociación espontánea del agua. La constante de disociación del agua, expresada por Kw, es la constante de reacción asociada a la reacción química de autoprotolisis:
Los productos de ésta reacción son los iones oxonio (o iones hidronio) y los hidroxilos. En el estado de equilibrio químico, y en el caso de disoluciones diluidas, el Kw corresponde al producto de las concentraciones en iones, que en el caso de una temperatura de 25°C, cumplen la relación:
- Kw = [H3O+]×[OH-] = 10-14
- y
- pKw = -log(Ke) = 14
Esta reacción del agua ocurre de manera natural y espontánea, de manera que en el agua a presión atmosférica se encuentran tanto moléculas de agua como iones en una relación de concentraciones acorde con la Kw específica a cada temperatura.
Categoría:- Magnitudes químicas
Wikimedia foundation. 2010.


![K_{d} = \frac{[A]^x \times [B]^y}{[A_x B_y]}](7/fa734f7c67752b156fc481a917e07f30.png)