- Control de reacción cinético y termodinámico
-
La distinción (también conocida como selectividad) entre las trayectorias de una reacción química controlada cinéticamente o termodinámicamente es relevante cuando el producto A se forma más rápidamente (el llamado producto cinéticamente controlado) que el producto B porque la energía de activación para el producto A es menor que para el producto B, aunque el producto B es más estable (el llamado producto termodinámicamente controlado).
Las condiciones de la reacción, como son la temperatura, presión, o solvente, afectan qué trayectoria de la reacción pueda ser favorecida: bien la controlada cinéticamente o la controlada termodinámicamente. Observe que esto es sólo cierto si la energía de activación de las dos trayectorias difieren, que una trayectoria tenga una energía de activación menor que la otra.
El diferenciar entre el control termodinámico de la reacción y el control cinético de la reacción para una reacción química específica determina la composición final de la mezcla de productos de la reacción cuando estas trayectorias de reacción compiten, conduciendo a productos diferentes. Las condiciones de reacción mencionadas arriba influyen sobre la selectividad de la reacción, esto es, qué trayectoria es tomada.
Ejemplos
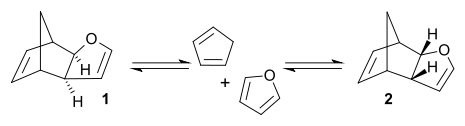
- La reacción de Diels-Alder del ciclopentadieno con el furano puede producir dos productos isoméricos. A temperatura ambiente, el control cinético de la reacción prevalece, y el principal producto de la reacción es el isómero endo 2, que es menos estable. A 81 °C, y después de un largo tiempo de reacción, el equilibrio químico puede alcanzar, y se forma el isómero exo 1, que es termodinámicamente más estable. El producto exo es más estable en virtud a un menor grado de congestión estérica, mientras que el producto endo está favorecido por el traslape de orbitales en el estado de transición.
- En la protonación de un anión enolato, el producto cinético es el enol, y el producto termodinámico es una cetona o aldehído. Los compuestos de carbonilo y sus enoles se intercambian rápidamente por transferencia de protones catalizada por ácidos o bases, incluso en cantidades traza, en este caso mediado por el enolato o la fuente de protones.
- En la deprotonación de una cetona asimétrica, el producto cinético es el enolato que resulta de la remoción del hidrógeno α más accesible, mientras que el producto termodinámico tiene el enolato más sustituido. Aquí, la diferencia en adición electrofílica del bromuro de hidrógeno a 1,3-butadieno a temperatura ambiente conduce predominantemente al aducto 1,4, que es termodinámicamente más estable: 1-bromo-2-buteno; pero la disminución de la temperatura de reacción por debajo de la temperatura ambiente favorece al aducto 1,2, que es cinético: 3-bromo-1-buteno. La razón para las selectividades diferentes es la siguiente: ambos productos resultan de la protonación Markovnikov en la posición 1, resultando en un catión alilo estabilizado por resonancia. El aducto 1,4 ubica al átomo de bromo grande en un sitio menos congestionado, e incluye un alqueno más sustituido, mientras que el aducto 1,2 es el resultado del ataque del nucleófilo (Br-) en el carbono del catión alílico que tiene la mayor carga positiva (el carbono más altamente sustituido).
Características
- En cada reacción, el primer producto formado es el que se forma más fácilmente. En consecuencia, cada reacción a priori comienza bajo control cinético. Esto no es cierto sólo si un equilibrio subsecuente es igual o más rápido.
- Una condición necesaria para el control termodinámico es la reversibilidad, o un mecanismo que permita el equilibrio entre los productos. Las reacciones son consideradas como si tuvieran lugar bajo un control de reacción termodinámico cuando la reacción reversa es suficientemente rápida, tal que el equilibrio se establezca dentro del tiempo de reacción. De esta forma, el producto termodinámico siempre estará favorecido.
- Bajo control cinético de reacción, la reacción directa es más rápida que la reacción reversa. Después de un tiempo de reacción t, la razón de productos está en la razón de sus velocidades de formación, y encontonces es una función de la diferencia en energías de activación Ea o ΔG‡:
![ln(\frac {[A]_t}{[B]_t}) = ln(\frac {k_A}{k_B}) = -\frac {\Delta E_a}{RT}](c/79ce0c3dd089428b0a716fad6942612b.png) (equation 1)
(equation 1)
- Salvo que el equilibrio sea evitado, el control cinético puro es prácticamente imposible, porque el equilibrio empezará una vez que todos los reactantes hayan sido consumidos.
- Bajo control de reacción termodinámico puro, cuando se ha alcanzado el equilibrio, la distribución de productos será función de las estabilidades G°. Después de una cantidad infinita de tiempo de reacción, la razón de las concentraciones de los productos será igual a la constante de equilibrio Keq y, en consecuencia, será una función de la diferencia en energía libre de Gibbs.
![ln(\frac {[A]_{\infty}}{[B]_{\infty}}) = ln\ K_{eq} = -\frac {\Delta G^\circ}{RT}](2/b02cc395beb0bcd283c2a89a8fea2bcb.png) (equation 2)
(equation 2)
- En general, menores tiempos de reacción favorecen el control cinético, mientras que largos tiempos de reacción favorecen el control termodinámico. Las bajas temperaturas favorecerán la selectividad bajo ciertas condiciones, dado que T está en el denominador en ambos casos. La temperatura ideal para optimizar el rendimiento del producto que se forma más rápido es la temperatura más baja que asegure el término de la reacción en un período razonable. A menos que uno esté satisfecho con una reacción incompleta. La temperatura ideal para una reacción bajo control termodinámico es la menor temperatura a la que se alcanzará el equilibrio en un período razonable. En el peor de los casos, Keq se aproximará a 1 a la vez que T aumenta, y la proporción del producto más estable tenderá a ser el 50% de la mezcla de reacción. Si se necesitara, la selectividad puede ser aumentada enfriando lentamente la mezcla de reacción para desplazar el equilibrio hacia el producto más estable. Cuando la diferencia en estabilidad de producto es muy grande, el producto controlado termodinámicamente puede dominar bajo condiciones de reacción aún más vigorosas.
- Si una reacción está bajo control termodinámico a una temperatura dada, también estará bajo control termodinámico a una temperatura mayor para el mismo tiempo de reacción.
- De la misma manera, si una reacción está bajo control cinético a una temperatura dada, estará bajo control cinético a cualquier temperatura menor para el mismo tiempo de reacción.
- Si uno presumo que una reacción estará a priori bajo control cinético, se puede detectar la presencia de un mecanismo de equilibrio (y, en consecuencia, la posibilidad de un control termodinámico) si la distribución de productos:
- cambia en el tiempo,
- muestra que un producto es dominante a una temperatura, mientras que otro domina a una temperatura diferente (inversión de dominancia), o
- cambia con la temperatura, pero no es consistente con la ecuación 1, que es que un cambio en la tempratura (sin cambiar el tiempo de reacción) causa un cambio en la razón de productos [A]t / [B]t que es mayor o menor que el que se esperaría por el mismo cambio de temperatura, asumiendo que ΔEa apenas cambia con la temperatura en un rango modesto de temperatura.
Referencias
- Organic Chemistry, 3rd ed., M. A. Foxe & J. K. Whitesell, Jones & Bartlett, 2004 ISBN 0-7637-2197-2
- A Guidebook to Mechanism in Organic Chemistry, 6th Edition, Peter Sykes, Pearson Prentice Hall, 1986. ISBN 0-582-44695-3
- Introduction to Organic Chemistry I, Seth Robert Elsheimer, Blackwell Publishing, 2000 ISBN 0-632-04417-9
Categorías:- Cinética química
- Reacciones químicas
- Termodinámica
Wikimedia foundation. 2010.