- Furano
-
Furano 
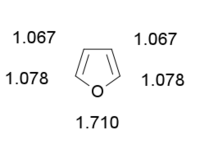
Nombre IUPAC Furano (u oxol) Otros nombres Furfurano, óxido de divinileno Fórmula empírica C4H4O Masa molecular 68,08 g/mol Estado físico/Color Líquido/Incoloro a marronoso Número CAS 110-00-9 Propiedades Densidad 0,94 g/cm3 a 20 °C Punto de fusión -85,6 °C (187,6 K) Punto de ebullición 31,3 °C (304,4 K) Solubilidad en agua 10 g/l a 25 °C Información de Seguridad 

Frases R: R45, R12, R20/22, R38, R48/22, R52/53, R68 Frases S: S53,S45,S61
Exenciones y Referencias[1] [2] [3] El furano es un compuesto orgánico heterocíclico. Es un líquido claro, incoloro, altamente inflamable y muy volátil, con un punto de ebullición cercano al de la temperatura ambiente. Es tóxico y puede ser carcinógeno.
Contenido
Historia
El nombre furano viene del Latín furfur que significa salvado.[4] El primer derivado del furano fue descripto como ácido 2-furoico, por Carl Wilhelm Scheele en 1780. Otro derivado importante, el furfural fue descripto por Johann Wolfgang Döbereiner en 1831 y caracterizado nueve años después por John Stenhouse. El furano como tal fue preparado por vez primera por Heinrich Limpricht en 1870, aunque en esa oportunidad fue llamado como tetrafenol.[5] [6]
Presencia en la naturaleza
El anillo de furano se forma en diversos compuestos de diferente naturaleza biosintética. Ejemplos notables son la salvinorina, el ipomeamarol, el óxido de carlina, la wierona, el perileno, el furomentano, las plakorsinas y la nufaridina. El anillo de tetrahidrofurano se encuentra ampliamente distribuido en la naturaleza en forma de γ-lactonas y furanosas.[7]
Síntesis
- Industrialmente: El furano se obtiene mediante la descarbonilación catalítica del furfural.
- Síntesis de Paal-Knorr: Consiste en la deshidratación mediante furfural por oxidación y descarboxilación del ácido furano-2-carboxílico resultante. El furfural puede ser obtenido por la destilación destructiva de la mazorca del maíz en presencia de ácido sulfúrico.[8]
- Otro método de síntesis orgánica es la Síntesis de Feist-Benary
Aromaticidad
El furano es un compuesto aromático que respeta la regla de Hückel. El furano, posee seis electrones deslocalizados: cuatro pertenecientes a los dobles enlaces y dos del átomo de oxígeno (uno de los dos pares no enlazados solamente, que se encuentra en un orbital perpendicular al plano del anillo). Cada carbono aporta un electrón mientras que el oxígeno aporta dos a la nube deslocalizada. Los carbonos son híbridos sp2. El furano resulta entonces con una energía de resonancia de entre 62,3-96,2 kJ/mol. Esta energía es inferior a aquella del benceno, del tiofeno y del pirrol. Por lo que el furano es menos aromático que estos. Esta débil aromaticidad del furano explica porqué el mismo actúa como un dieno cíclico en ciertas reacciones de Diels-Alder
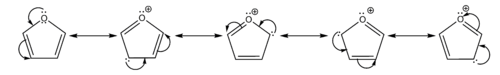
El átomo de oxígeno posee un efecto mesómero como donante y un efecto inductivo electroatrayente. La deslocalización del par libre de electrones contribuye al efecto mesómero del oxígeno mientras que la atracción de los electrones de los enlaces C-O hacia el átomo de oxígeno corresponden al efecto inductivo. La naturaleza electroatrayente del oxígeno tiene efectos sobre la distribución electrónica en el ciclo pero este hecho no alcanza para que se contrarreste el efecto mesómero. Por consiguiente, entonces, el oxígeno aporta globalmente una densidad electrónica suplementaria al ciclo. Esta contribución electrónica del oxígeno se traduce por los valores de densidad electrónica superiores a 1 para los carbonos del ciclo. El efecto mesómero donante del oxígeno da origen a una carga positiva sobre el mismo y una carga negativa sobre los carbonos en cuatro de las cinco estructuras resonantes del ciclo.
El oxígeno posee además otro par de electrones que no está deslocalizado. El furano es un compuesto plano e igualmente a sus homólogos (tiofeno y pirrol), es un sistema π excedente debido a la distribución de 6 electrones π deslocalizados en cinco átomos; la densidad electrónica es por lo tanto claramente más importante que en sus análogos del benceno. Por otra parte, contrariamente a los ciclos aromáticos simples de 6 elementos, solo una de sus estructuras de resonancia es neutra; mientras que las otras formas existen en forma de zwitterión. Estas formas cargadas contribuyen minoritariamente al híbrido de resonancia, pero por esto también, la química del furano será en parte aquella la de los compuestos aromáticos y en parte a aquella de los dienos.
Reacciones
Debido a la deslocalización del par de electrones del átomo de oxígeno por el anillo, π-excedente, el furano es más reactivo frente a la sustitución electrófila aromática que el benceno. No es resistente a los reactivos ácidos concentrados que se usan en la química del benceno para efectuar la sulfonación y nitración.
- El furano tiene carácter de dieno en la reacción de Diels-Alder, reaccionando con dienófilos pobres en electrones.
- En condiciones suaves, en medio acuoso acidificado, el furano hidroliza dando lugar al correspondiente compuesto 1,4-dicarbonílico. Sería la reacción inversa a la de Paal-Knorr.
- La hidrogenación del furano mediante catálisis heterogénea (esto implica un catalizador metálico) conduce al tetrahidrofurano.
- Reacción de Achmatowicz donde el furano se convierte en un dihidropirano.
Aplicaciones
Se usa principalmente como intermedio en la producción industrial de tetrahidrofurano.
Se utiliza en la producción de lacas, como disolvente para resinas y en la síntesis de productos químicos para la agricultura (insecticidas), estabilizantes y productos farmaceúticos (química fina).
Es útil también para sintetizar nitrofuranos, un grupo de fármacos con actividad antibacteriana, antituberculosa e incluso antitumoral.
Referencias
- ↑ Fichas internacionales de seguridad química (FISQ)
- ↑ Fichas de datos de seguridad (FDS)
- ↑ Hazardous Substances Data Bank (HSDB)
- ↑ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 0-444-52239-5.
- ↑ Limpricht, H. (1870). «Ueber das Tetraphenol C4H4O». Berichte der deutschen chemischen Gesellschaft 3 (1): pp. pp. 90–91. doi:.
- ↑ Rodd, Ernest Harry (1971). Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier.
- ↑ Paul M. Dewick (2009). Medicinal natural products: a biosynthetic approach. John Wiley and Sons. ISBN 0470741686, 9780470741689.
- ↑ "Furan". Org. Synth.; Coll. Vol. 1: 274.
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A.. ISBN 84-282-0882-4.
- W.R. Peterson (1996). Formulación y nomenclatura química orgánica. Barcelona: EDUNSA - Ediciones y distribuciones universitarias S.A.. ISBN 84-85257-03-0.
- J. A. Joule, K. Mills y G. F. Smith (1995). «15» (en Inglés). Heterocyclic Chemistry (Third edición). Chapman & Hall. pp. 280. ISBN 0 412 41340 X.
Enlaces externos
Categoría:- Furanos
Wikimedia foundation. 2010.