- Dominio Kringle
-
Dominio Kringle
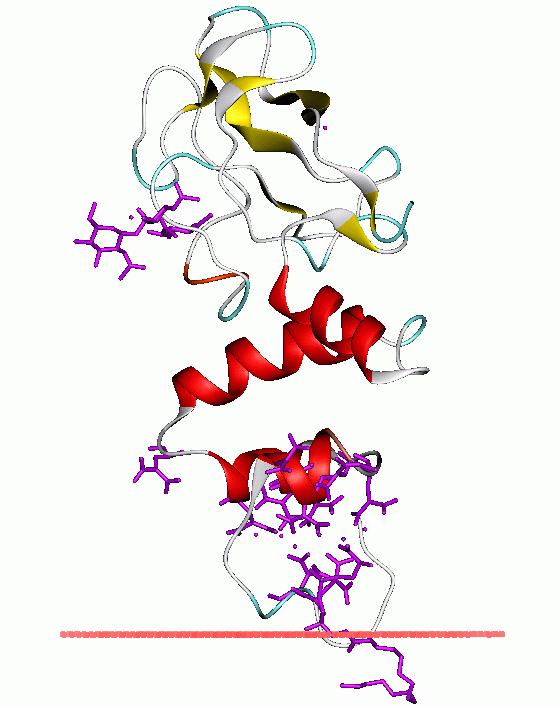
El dominio Kringle es un dominio de proteínas que se pliega en grandes bucles estabilizados por tres enlaces disulfuro. Estos dominos son importantes en las interacciones proteína-proteína con factores de coagulación de la sangre. El nombre proviene del pastel escandinavo kringle, debido a que estas estructuras se asemejan a su forma.
Los dominios Kringle se han encontrado en plasminógeno, factor de crecimiento de hepatocitos, protrombina, y lipoproteína (a).
Los dominios Kringle se encuentran en las proteínas de la coagulación de la sangre y fibrinolíticas. Se piensa que estos dominios desempeñan un papel en la unión de mediadores (e.g. membranas, otras proteínas o fosfolípidos), y en la regulación de la actividad proteolítica.[1] [2] [3] Los dominios Kringle se caracterizan por un bucle triple, una estructura de tres enlaces disulfuro, cuya conformación está definida por una serie de enlaces de hidrógeno y pequeñas piezas de láminas beta antiparalelas. Se encuentran en un número variable de copias en algunas proteínas del plasma, incluyendo la protrombina y activadores de plasminógeno tipo uroquinasa, que son proteasas de serina pertenecientes a la familia S1A de la peptidasa MEROPS.[4] [5] [6]
Proteínas humanas conteniendo este dominio
ATF; F12; F2; HABP2; HGF; HGFAC; KREMEN1; KREMEN2; LPA; LPAL2; MST1; PIK3IP1; PLAT; PLAU; PLG; PRSS12; ROR1; ROR2;
Referencias
- ↑ Fujikawa K, McMullen BA (1985). «Amino acid sequence of the heavy chain of human alpha-factor XIIa (activated Hageman factor)» J. Biol. Chem.. Vol. 260. n.º 9. pp. 5328–5341. PMID 3886654.
- ↑ Patthy L, Trexler M, Banyai L, Varadi A, Vali Z (1984). «Kringles: modules specialized for protein binding. Homology of the gelatin-binding region of fibronectin with the kringle structures of proteases» FEBS Lett.. Vol. 171. n.º 1. pp. 131–136. DOI 10.1016/0014-5793(84)80473-1. PMID 6373375.
- ↑ Atkinson RA, Williams RJ (1990). «Solution structure of the kringle 4 domain from human plasminogen by 1H nuclear magnetic resonance spectroscopy and distance geometry» J. Mol. Biol.. Vol. 212. n.º 3. pp. 541–552. DOI 10.1016/0022-2836(90)90330-O. PMID 2157850.
- ↑ Castellino FJ, Beals JM (1987). «The genetic relationships between the kringle domains of human plasminogen, prothrombin, tissue plasminogen activator, urokinase, and coagulation factor XII» J. Mol. Evol.. Vol. 26. n.º 4. pp. 358–369. DOI 10.1007/BF02101155. PMID 3131537.
- ↑ Patthy L (1985). «Evolution of the proteases of blood coagulation and fibrinolysis by assembly from modules» Cell. Vol. 41. n.º 3. pp. 657–663. DOI 10.1016/S0092-8674(85)80046-5. PMID 3891096.
- ↑ Takahashi K, Ikeo K, Gojobori T (1991). «Evolutionary origin of numerous kringles in human and simian apolipoprotein(a)» FEBS Lett.. Vol. 287. n.º 1. pp. 146–148. DOI 10.1016/0014-5793(91)80036-3. PMID 1879523.
Categoría: Dominios de proteínas
Wikimedia foundation. 2010.
