- Ecuación de Eyring
-
Ecuación de Eyring
La ecuacion de Eyring también conocida como ecuación de Eyring–Polanyi en Cinética química relaciona la velocidad de reacción con la temperatura. Fue desarrollada casi simultáneamente en 1935 por Henry Eyring, M.G. Evans y Michael Polanyi. Esta ecuación es parte de la teoría del estado de transición (o bien, teoría del complejo activado) y equivale de modo trivial a la ecuacion de Arrhenius obtenida empíricamente; ambas ecuaciones pueden derivarse fácilmente de la termodinámica estadística en la teoría cinética de gases.[1]
La forma form de la ecuacion de Eyring–Polanyi recuerda algo a la ecuacion de Arrhenius:
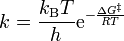
donde ΔG‡ es la energía libre de activacion, kB es la constante de Boltzmann, y h is es la constante de Planck.Puede reescribirse como:
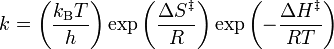
Para encontrar la forma lineal de la ecuación de Eyring–Polanyi partimos de :
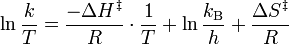
donde: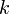 = constante de la velocidad de reacción
= constante de la velocidad de reacción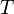 = temperatura absoluta
= temperatura absoluta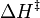 = entalpía de activación
= entalpía de activación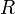 = constante de los gases ideales
= constante de los gases ideales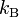 = constante de Boltzmann
= constante de Boltzmann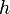 = constante de Planck
= constante de Planck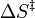 = entropía de activación
= entropía de activación
Una cierta reacción química tiene lugar a diferentes temperaturas y se determinan las velocidades de reacción. La gráfica de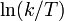 versus
versus 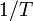 da una línea recta con pendiente
da una línea recta con pendiente 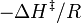 de la cual puede derivarse la entalpía de activación y de la ordenada en el origen o punto de corte con el eje de ordenadas
de la cual puede derivarse la entalpía de activación y de la ordenada en el origen o punto de corte con el eje de ordenadas 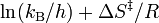 se deriva la entropía de activación.
se deriva la entropía de activación.
The Mathematical Theory of Non-uniform Gases : An Account of the Kinetic Theory of Viscosity, Thermal Conduction and Diffusion in Gases Sydney Chapman, T. G. CowlingReferencias
- ↑ Chapman & Enskog 1939
- Evans, M.G.; Polanyi M. (1935). «Some applications of the transition state method to the calculation of reaction velocities, especially in solution» Trans. Faraday Soc.. Vol. 31. pp. 875. DOI 10.1039/tf9353100875.
- Eyring, H. (1935). «The Activated Complex in Chemical Reactions» J. Chem. Phys.. Vol. 3. pp. 107. DOI 10.1063/1.1749604.
- Eyring, H.; Polanyi M. (1931). Z. Phys. Chem. Abt. B. Vol. 12. pp. 279.
- Laidler, K.J.; King M.C. (1983). «The development of Transition-State Theory» J. Phys. Chem.. Vol. 87. pp. 2657–2664. DOI 10.1021/j100238a002.
- Polanyi, J.C. (1987). «Some concepts in reaction dynamics. Science» Vol. 236. n.º 4802. pp. 680–690.
Enlaces externos
Categorías: Cinética química | Dinámica química | Ecuaciones | Fisicoquímica
Wikimedia foundation. 2010.
