- Ecuación de Arrhenius
-
La ecuación de Arrhenius es una expresión matemática que se utiliza para comprobar la dependencia de la constante de velocidad (o cinética) de una reacción química con respecto a la temperatura a la que se lleva a cabo esa reacción.[1] La ecuación fue propuesta primeramente por el químico holandés J. H. van 't Hoff en 1884; cinco años después en 1889 el químico sueco Svante Arrhenius dio una justificación física y una interpretación para la ecuación. Actualmente, es vista mejor como una relación empírica.[2] Puede ser usada para modelar la variación de temperatura de coeficientes de difusión, población de vacancias cristalinas, velocidad de fluencia, y muchas otras reacciones o procesos inducidos térmicamente.
Contenido
Información general
Dicho de manera breve, la ecuación de Arrhenius da la dependencia de la constante de velocidad k de reacciones químicas a la temperatura T (en temperatura absoluta, tales como kelvins o grados Rankine) y la energía de activación[3] Ea", de acuerdo con la expresión:[1]
donde:
- k(T): constante cinética (dependiente de la temperatura)
- A: factor preexponencial o factor de frecuencia. Refleja la frecuencia de las colisiones.
- Ea: energía de activación, expresada en J/mol.
- R: constante universal de los gases. Su valor es 8,3143 J·K-1·mol-1
- T: temperatura absoluta [K]
Gráfico de Arrhenius
Ejemplo:
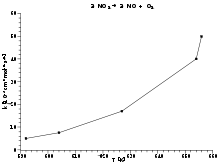
Decaimiento de dióxido de nitrógeno2 NO2 → 2 NO + O2 Para utilizar la ecuación de Arrhenius como modelo de regresión lineal entre las variables K y T − 1, la ecuación puede ser reescrita como:
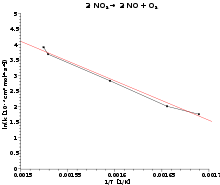
Un gráfico de Arrhenius muestra el logaritmo de las constantes cinéticas (ln(k) en el eje de las ordenadas en coordenadas cartesianas) graficado con respecto al inverso de la temperatura (1 / T, en el eje de las abcisas). Los gráficos de Arrhenius son ocasionalmente utilizados para analizar el efecto de la temperatura en las tasas de rapidez de las reacciones químicas. Para un único proceso térmicamente activado de velocidad limitada, un gráfico de Arrhenius da una línea recta, desde la cual pueden ser determinados tanto la energía de activación como el factor preexponencial.
Cuando se grafica de la forma descrita anteriormente, el valor de la intersección en el eje y corresponderá a ln(A), y la pendiente de la línea será igual a − Ea / R.
El factor preexponencial, A, es una constante de proporcionalidad que toma en cuenta un número de factores tales como la frecuencia de colisión y la orientación entre las partículas reaccionantes.
La expresión
 representa la fracción de las moléculas presentes en un gas que tienen energía igual o superior a la energía de activación a una temperatura dada.
representa la fracción de las moléculas presentes en un gas que tienen energía igual o superior a la energía de activación a una temperatura dada.Interpretación cinética de la ecuación de Arrhenius
Arrhenius argumentó que para que los reactivos se transformen en productos, deben primero adquirir una mínima cantidad de energía, llamada la "energía de activación" Ea. A una cierta temperatura absoluta T, la fracción de las moléculas que tiene una energía cinética mayor que Ea puede ser calculada a partir de la distribución de Maxwell-Boltzmann de la mecánica estadística, y resulta ser proporcional a
 . El concepto de energía de activación explica la naturaleza exponencial de la relación, y de una forma u otra está presente en todas las teorías cinéticas.
. El concepto de energía de activación explica la naturaleza exponencial de la relación, y de una forma u otra está presente en todas las teorías cinéticas.Teoría de las colisiones
Un ejemplo viene de la "teoría de las colisiones" de las reacciones químicas, desarrollada por Max Trautz y William Lewis en los años 1916-1918. En esta teoría, se supone que las moléculas reaccionan si colisionan con una energía cinética relativa a lo largo de sus líneas de centro, que exceda Ea. Esto lleva a una expresión muy similar a la ecuación de Arrhenius.
Teoría del estado de transición
Otra expresión parecida a la ecuación de Arrhenius aparece en la "teoría del estado de transición" de las reacciones químicas, formulada por Eugene Wigner, Henry Eyring, Michael Polanyi y M. G. Evans en los años 1930s. Esto toma varias formas, pero una de las más comunes es
donde ΔG‡ es la energía libre de Gibbs de activación, kB es la constante de Boltzmann, y h es la constante de Planck.
A primera vista esto luce como un exponencial multiplicado por un factor que es lineal en temperatura. Sin embargo, se debe recordar que la energía libre es por sí misma una cantidad dependiente de la temperatura. La energía libre de activación es la diferencia de un término de entalpía y un término de entropía multiplicada por la temperatura absoluta. Cuando todos los detalles son considerados, se termina con una expresión que nuevamente toma la forma de la ecuación exponencial de Arrhenius multiplicada por una función de T que varía lentamente. La forma precisa de la dependencia de temperatura depende de la reacción, y puede ser calculada usando fórmulas de la mecánica estadística, que envuelven las funciones de partición de los reactivos y del complejo activado.
Limitaciones de la idea de la energía de activación de Arrhenius
Tanto la energía de activación de Arrhenius como la constante de velocidad k son determinadas experimentalmente, y representan parámetros macroscópicos específicos de la reacción que no están relacionados de manera simple a las energías umbrales y al éxito de las colisiones individuales a nivel molecular. Considérese una colisión particular (una reacción elemental) entre las moléculas A y B. El ángulo de colisión, la energía traslacional relativa, la energía (particularmente la vibracional) interna, todos esos factores determinarán la oportunidad de que la colisión produzca una molécula AB. Las medidas macroscópicas de E y k son el resultado de muchas colisiones individuales con diferentes parámetros de colisión. Para probar las velocidades de reacción a nivel molecular, los experimentos tienen que ser realizados bajo condiciones casi colisionales y este tópico es llamado en ocasiones dinámica de reacciones moleculares.
Véase también
Referencias
- ↑ a b Ecuación de Arrhenius - IUPAC Goldbook definition
- ↑ Kenneth Connors, Chemical Kinetics, 1990, VCH Publishers
- ↑ Energía de activación de Arrhenius - IUPAC Goldbook definition
Wikimedia foundation. 2010.