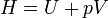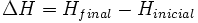- Entalpía
-
Entalpía
Entalpía (del prefijo en y del griego "enthalpos" (ενθαλπος) calentar) es una magnitud de termodinámica simbolizada con la letra H, la variación de entalpía expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico, o, lo que es lo mismo, la cantidad de energía que tal sistema puede intercambiar con su entorno.
En la historia de la termodinámica se han utilizado distintos términos para denotar lo que hoy conocemos como entalpía de un sistema. Originalmente se pensó que la palabra "entalpía" fue creada por Émile Clapeyron y Rudolf Clausius a través de la publicación de la relación de Clausius-Clapeyron en The Mollier Steam Tables and Diagrams de 1827, pero el primero que definió y utilizó término "entalpía" fue el holandés Heike Kamerlingh Onnes, a principios del siglo XX.[1]
En palabras más concretas, es una función de estado de la termodinámica donde la variación permite expresar la cantidad de calor puesto en juego durante una transformación isobárica (es decir, a presión constante) en un sistema termodinámico (teniendo en cuenta que todo objeto conocido puede ser entendido como un sistema termodinámico), transformación en el curso de la cual se puede recibir o aportar energía (por ejemplo la utilizada para un trabajo mecánico). En este sentido la entalpía es numéricamente igual al calor intercambiado con el ambiente exterior al sistema en cuestión.
Usualmente la entalpía se mide, dentro del Sistema Internacional de Unidades, en julios.
Contenido
Casos
El caso más típico de entalpía es la llamada entalpía termodinámica. De ésta, cabe distinguir la función de Gibbs, que se corresponde con la entalpía libre, mientras que la entalpía molar es aquella que representa un mol de la sustancia constituyente del sistema.
Entalpía termodinámica
La entalpía (simbolizada generalmente como "H", también llamada contenido de calor, y calculada en julios en el sistema internacional de unidades o también en kcal o, si no, dentro del sistema anglo: "BTU"), es una variable de estado, (lo que quiere decir que, sólo depende de los estados inicial y final) que se define como la suma de la energía interna de un sistema termodinámico y el producto de su volumen y su presión.
La entalpía total de un sistema no puede ser medida directamente, al igual que la energía interna, en cambio, la variación de entalpía de un sistema sí puede ser medida experimentalmente. El cambio de la entalpía del sistema causado por un proceso llevado a cabo a presión constante, es igual al calor absorbido por el sistema durante dicho proceso.
La entalpía se define mediante la siguiente fórmula:
Donde:
- H es la entalpía (en julios).
- U es la energía interna (en julios).
- p es la presión del sistema (en pascales).
- V es el volumen del sistema (en metros cúbicos).
-
- Ejemplo:
Debemos considerar que los procesos de transferencia térmica en un sistema, deben estar contenidos en un ambiente, como por ejemplo: el circuito cerrado de un fluido dentro de las cañerías de un sistema de refrigeración como los de los frigoríficos y el ambiente donde se acondiciona la temperatura que debe estar aislado del medio exterior.
Dentro del sistema el fluido pasa por diferentes estados físicos tomando como referencia la salida de alta presión del compresor tenemos;
A.- A un fluido refrigerante el compresor le adiciona energía comprimiéndolo a alta presión en estado gaseoso, las variables son: estado del fluido = Gaseoso, Presión del fluido = Alta, Volumen del fluido = grande, Densidad del fluido = baja, Temperatura = Alta.
B.- En un medio que permite la transferencia térmica llamado condensador, el fluido realiza un trabajo cediendo energía calórica al medio ambiente, es decir se enfría y cambia de estado gaseoso al estado líquido, las variables son: estado del fluido = gaseoso a la entrada del intercambiador de calor y líquido a la salida del intercambiador de calor; presión del fluido = muy alta; volumen del fluido líquido = mínimo, densidad del fluido = grande o máximo. El fluido líquido se junta en un depósito.
C.- Con un medio de control adecuado llamado válvula de expansión termostática se regula el caudal del fluido líquido.
D.- Nuevamente el fluido en estado líquido se inyecta en un medio que permite la transferencia térmica llamado evaporador, realizando ahora un trabajo inverso es decir el líquido proveniente del depósito y a presión alta es regulado por la válvula de expansión por diferencia de presiones, disminuyendo bruscamente de presión lo que origina que se expanda, esto precipita su evaporación para lo que requiere extraer calor del entorno (por lo que decimos que se está enfriando ya que se siente helado al tacto, pues nos "roba calor",calor que utiliza para cambiar de estado líquido a gaseoso) (ver adiabática), los productos que están en el compartimiento del evaporador realizan un trabajo cediendo ese calor, este calor calienta el evaporador y el fluido refrigerante por ende absorbe calor expandiéndose (y evaporándose) más, las variables son: estado del fluido = líquido a la entrada del intercambiador de calor o evaporador y gaseoso a la salida del intercambiador de calor. Presión del fluido = mínima o muy baja. Volumen del fluido gasificado = Máximo. Densidad del fluido = Mínimo. Temperatura del fluido refrigerador muy baja.
Después de esta etapa se vuelve otra vez al ciclo iniciado en el punto A repitiendo (en teoría) infinitamente el ciclo completo (ver retroalimentación).
Debemos observar que en este sistema hay 4 importantes elementos que combinados adecuadamente hacen posible la refrigeración mecánica,hoy indispensable en la vida del hombre moderno.
1.- El primer elemento es el compresor que suministra potencia o adiciona energía mecánica externa al sistema al comprimir el fluido gaseoso interno, de tal manera que la presión (y como consecuencia la temperatura) del mismo aumentan.
2.- El segundo elemento es el medio difusor de energía calorífica, llamado intercambiador de calor que permite liberar el calor del fluido desde este al entorno próximo (medio ambiente que lo rodea, flujo de agua, etc)a través de las paredes de los tubos y aletas del condensador . De esta forma el fluido refrigerante a alta presión en el interior del condensador por efecto del enfriamiento del mismo cambia de estado gaseoso a fase líquido sin disminuir (idealmente) su presión. El refrigerante ahora más frío, líquido y a alta presión (10 kg/cm² - 15 kg/cm²) es incompresible por lo tanto se debe recolectar en un tubo o depósito, como ejemplo; los tubos de gas butano licuado (gas que se usa en las cocinas domésticas).
3.- El fluido guardado en el depósito en estado líquido es transferido al tercer elemento del sistema llamado la válvula de expansión (válvula de temperatura estable) que regulará el caudal o flujo másico del líquido refrigerante entregándolo al cuarto elemento del sistema, un nuevo intercambiador de calor que ahora funcionará inversamente,por lo que su nombre varía al de evaporador (ya que el refrigerante se evapora en su interior), es decir captará el calor del aire del medio ambiente o entorno que lo rodea a través de sus paredes hacia el refrigerante.Es por esto que al ir recorriendo el interior de los tubos del evaporador el fluido se va calentando, con lo que las moléculas del refrigerante en estado líquido al incrementar su energía interna aumentan su frecuencia vibratoria (La cantidad de calor de un cuerpo a nivel molecular se manifiesta como mayor o menor vibración, en donde la inamovilidad atómica y molecular representa ausencia total de calor, 0 kelvin o cero absoluto) llegando a un punto que es tan grande la velocidad de estas que se escapan cambiando de estado de líquido a gaseoso (para más detalles sobre este punto véase adiabática).
Este ciclo en teoría se repite infinitamente, como se podrá observar el funcionamiento de este ingenio llamado máquina de refrigeración se puede extractar en dos pasos;
A.- Etapa de alta presión que estará compuesta por el compresor, condensador y depósito acumulador.
B.- Etapa de baja presión compuesta por la válvula termostática y el evaporador.
El modo de funcionamiento sería de la siguiente forma;
En un ambiente acondicionado por su hermeticidad las cosas guardadas en esta cámara (freezer, congelador, cámara frigorífica, etc) ceden energía (bajando su temperatura) a través de un intercambiador de calor llamado evaporador, hacia el fluido refrigerante, propiciando su cambio de estado de líquido a gas (líquido hirviendo), el que a su vez de acuerdo a la disposición del circuito cede energía (bajando la temperatura del fluido) al medio ambiente exterior (el aire que nos rodea) a través de otro intercambiador de calor llamado condensador.
El anterior es solo un ejemplo para poder comprender el concepto de entalpía, tal ejemplo se observa comúnmente en los refrigeradores o en los aparatos de aire acondicionado; existen múltiples formas de aplicación práctica al uso cotidiano de la entalpía como por ejemplo el concepto de absorción.
Sin importar si la presión externa es constante, la variación infinitesimal de la entalpía obedece a:
- dH = T dS + V dP
-
-
-
-
- dP = 0 y por lo tanto dH = TdS
-
-
-
-
(S es la entropía) siempre y cuando el único trabajo realizado sea a través de un cambio de volumen. La entalpía es la cantidad de calor, a presión constante, que transfiere una sustancia.Puesto que la expresión T dS siempre representa una transferencia de calor, tiene sentido tratar la entalpía como una medida del calor total del sistema, siempre y cuando la presión se mantenga constante; esto explica el término contenido de calor.
Entalpía química
Para una reacción exotérmica a presión constante, la variación de entalpía del sistema es igual a la energía liberada en la reacción, incluyendo la energía conservada por el sistema y la que se pierde a través de la expansión contra el entorno.(Es decir que cuando la reacción es exotérmica la entalpía del sistema es negativa). Análogamente, para una reacción endotérmica, la variación de entalpía del sistema es igual a la energía absorbida durante la reacción, incluyendo la energía perdida por el sistema y la ganada a través de la expansión contra el entorno.(En las reacciones endotérmicas el cambio de entalpía es positivo para el sistema, porque gana calor)
La entalpía total de un sistema no puede ser medida directamente; la variación de entalpía de un sistema sí puede ser medida en cambio.
La variación de entalpía se define mediante la siguiente ecuación:
- ΔH es la variación de entalpía.
- Hfinal es la entalpía final del sistema. En una reacción química, Hfinal es la entalpía de los productos.
- Hinicial es la entalpía inicial del sistema. En una reacción química, Hinicial es la entalpía de los reactivos.
La mayor utilidad de la entalpía se obtiene para analizar reacciones que incrementan el volumen del sistema cuando la presión se mantiene constante por contacto con el entorno, provocando que se realice un trabajo mecánico sobre el entorno y una pérdida de energía. E inversamente en reacciones que causan una reducción en el volumen debido a que el entorno realiza un trabajo sobre el sistema y se produce un incremento en la energía interna del sistema.
Entalpía estándar o normal
La variación de la entalpía estándar (denotada como H0 o H
O) es la variación de entalpía que ocurre en un sistema cuando una unidad equivalente de materia se transforma mediante una reacción química bajo condiciones normales. Sus unidades son los kJ/mol en el sistema internacional.Una variación de la entalpía estándar de una reacción común es la variación de la entalpía estándar de formación, que ha sido determinada para una gran cantidad de sustancias. La variación de entalpía de cualquier reacción bajo cualesquiera condiciones se puede computar, obteniéndose la variación de entalpía de formación de todos los reactivos y productos. Otras reacciones con variaciones de entalpía estándar son la combustión (variación de la entalpía estándar de combustión) y la neutralización (variación de la entalpía estándar de neutralización).
Otros usos
En magnetohidrodinámica se tratan de aprovechar las diferencias de entalpía para generar, con utilidad práctica, electricidad.
Referencias
Véase también
- Entalpía libre
- Entalpía molar
- Calor másico
- Diagrama de entalpía
- Entalpía y evaporación
- Entropía
- Ley de Joule
- monobara
- Exergía
- Función de estado, variable de estado, ecuación de estado
Categorías: Termodinámica | Magnitudes termodinámicas | Teoría de sistemas
Wikimedia foundation. 2010.