- Naftalina
-
Naftalina
Nombre (IUPAC) sistemático biciclo(4.4.0)deca-1,3,5,7,9-Hexeno General Otros nombres Neftaleno Fórmula molecular C10H8 Identificadores Número CAS 91-20-3 PubChem ChemSpider 906 ChEBI 16482 UNII 2166IN72UN Número RTECS QJ0525000 Propiedades físicas Estado de agregación sólido Apariencia Cristales blancos / hojuelas,
fuerte olorDensidad 1140 kg/m3; 1,14 g/cm3 Masa molar 128,17052 g/mol Punto de fusión 353 K (79,85 °C) Punto de ebullición 491 K (217,85 °C) Propiedades químicas Solubilidad en agua No soluble en agua Peligrosidad Punto de inflamabilidad 356 K (83 °C) NFPA 704 Temperatura de autoignición 798 K (525 °C) Número RTECS QJ0525000 Riesgos Inflamable, sensibilizante, posible carcinogeno. En polvo puede formar una mezcla explosiva con el aire Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa naftalina (nombre comercial del naftaleno, C10H8) es un sólido blanco que se volatiliza fácilmente y se produce naturalmente cuando se queman combustibles. También se llama alquitrán blanco y se ha usado en bolas y escamas para ahuyentar las polillas. Quemar tabaco o madera produce naftalina. Tiene un olor fuerte, aunque no desagradable. La 1-metilnaftalina y la 2-metilnaftalina son compuestos similares a la naftalina. La 1-metilnaftalina es un líquido transparente y la 2-metilnaftalina es un sólido; ambos pueden olerse en el aire y en el agua en concentraciones muy bajas. Su temperatura de fusión es 80 °C. Calor latente de fusión LF = 35,6 cal/g. El calor específico es 0,41 cal/g °C = 1,72 KJ/kg-K = 0,239 cal/g-K = 0,41 BTU/lb°F. Es soluble en grasas.
Contenido
Producción
La mayor parte de naftaleno se obtiene a partir de alquitrán de hulla. Desde la década de 1960 hasta la década de 1990, importantes cantidades de naftaleno también fueron producidos a partir de fracciones pesadas de petróleo durante el refinado de petróleo, en la actualidad el naftaleno derivado del petróleo sólo representa un componente menor de la producción de naftaleno.
El naftaleno es el componente más abundante del alquitrán de hulla. Aunque la composición varía con el carbón del que se produce, siendo aproximadamente 10% en peso de naftaleno. En la práctica industrial, de la destilación de alquitrán de hulla se obtiene un aceite que contiene aproximadamente 50% de naftaleno, junto con una variedad de otros compuestos aromáticos. Este aceite, después de ser lavado con de hidróxido de sodio acuoso para eliminar los componentes ácidos (principalmente varios tipos de fenoles), y con ácido sulfúrico para eliminar componentes básicos, se somete a destilación fraccionada para aislar naftaleno. El naftaleno bruto resultante de este proceso es de alrededor del 95% en peso de naftaleno, a menudo referido como 78 °C (punto de fusión).
El naftaleno derivado del petróleo es generalmente más puro que el procedente del alquitrán de hulla. Cuando se necesita crudo de naftaleno puede ser purificado por recristalización a partir de cualquiera de una variedad de disolventes, lo que resulta en 99% en peso de naftaleno, denominado 80 °C (punto de fusión). Aproximadamente 1 millón de toneladas se producen anualmente.
En América del Norte son productores basados en el alquitrán de hulla: Koppers Inc. and Recochem Inc., y derivado del petróleo: Advanced Aromatics, LP.
Estructura y reactividad
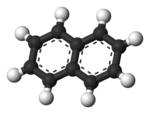
Una molécula de naftaleno se deriva de la fusión de un par de anillos de benceno. (En la química orgánica, los anillos se funden, por dos o más átomos comunes.) En consecuencia, naftaleno está clasificado como un Hidrocarburo aromático policíclico (HAP). Hay dos conjuntos de átomos de hidrógeno equivalentes: el alfa de posiciones son las posiciones 1, 4, 5, y 8 en el dibujo a continuación, la versión beta y posiciones son las posiciones 2, 3, 6, y 7.
A diferencia de benceno, los enlaces de carbono-carbono en el naftaleno no son de la misma longitud. Los enlaces C1-C2, C3, C4, C5 y C6-C7-C8 se acerca 1,36 Å (136 pm) de longitud, mientras que el resto de los bonos de carbono-carbono son aproximadamente 1,42 Å (142 pm) de largo. Esa diferencia, que fue establecida por difracción de rayos-x, es coherente con los enlaces de valencia modelados en la vinculación de naftaleno que comprende tres estructuras de resonancia (como se muestra a continuación), mientras que los enlaces de C1-C2, C3, C4, C5, C6 y C7 C8-dobles en dos de las tres estructuras, los otros son el doble en sólo una.
Como el benceno, el naftaleno puede someterse a sustitución electrofilica de aromáticos. Para muchas de estas reacciones, el naftaleno reacciona bajo condiciones más leves que el benceno. Por ejemplo, mientras que el benceno y el naftaleno reacciona con cloro en presencia de un cloruro férrico o cloruro de aluminio catalizador, naftaleno y el cloro puede reaccionar para formar 1-cloronaftaleno incluso sin un catalizador. Del mismo modo, el benceno y el naftaleno puede ser alquilados utilizando reacciones de Friedel-Crafts, el naftaleno también pueden ser alquilado por reacción con alquenos o alcoholes, con el ácido sulfúrico o el ácido fosfórico como catalizador.
Usos
Hoy existe el mito de que la naftalina sirve para elevar los octanos de la gasolina comercial, esto es parcialmente verdad, ya que los compuestos muy volátiles tienden a mejorar el octanaje (RON, o MON). Pero industrialmente no sería factible utilizar a la naftalina como un mejorador del número de octano porque es un hidrocarburo aromático policíclico, y como tal, un contaminante considerado peligroso. Por lo tanto se recurre a otros mejoradores del número de octano.
Referencias
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre NaftalinaCommons.
Wikimedia Commons alberga contenido multimedia sobre NaftalinaCommons.
- ATSDR en Español - ToxFAQs™ para naftalina, 1-metilnaftalina, 2-metilnaftalina
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la naftalina de mgl.
Categoría:- Hidrocarburos aromáticos policíclicos
Wikimedia foundation. 2010.

