- Punto de ebullición
-
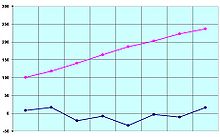 Puntos de fusión en azul y puntos de ebullición en rosa de los primeros ocho ácidos carboxilicos (en °C).
Puntos de fusión en azul y puntos de ebullición en rosa de los primeros ocho ácidos carboxilicos (en °C).
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a estado gaseoso, es decir hierve. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido.[1] En esas condiciones se puede formar vapor en cualquier punto del líquido.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que lo componen).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo inducido o puentes de hidrógeno)
Cálculo del punto de ebullición
El punto de ebullición normal puede ser calculado mediante la fórmula de Clausius-Clapeyron:

donde: TB =Punto de ebullición normal en Kelvin R = Constante ideal del gas, 8,314 J · K-1 · mol-1 P0 = Presión del vapor a una temperatura dada, en atmósferas (atm) ΔHvap = Calor de vaporización del líquido, J/mol T0 = La temperatura dada en Kelvin ln = logaritmo en base e Véase también
- Punto de fusión
- Elevación del punto de ebullición
- Punto crítico
Referencias
- ↑ Química. Problemas y ejercicios de aplicación para Química
Autor: Mohina, Davel Editorial: Eudeba Edición: 1º-2010
ISBN : 978-950-23-1702-1 pagina 27
Categorías:- Estados de la materia
- Propiedades químicas
- Temperatura
Wikimedia foundation. 2010.
