- Nailon
-
Nailon Densidad 1150 kg/m³ Conductividad eléctrica(σ) 10-12 (m·ohm)-1 Conductividad térmica 0.25 W/(m·K) El nailon (de la marca comercial registrada: nylon®) es un polímero artificial que pertenece al grupo de las poliamidas. Se genera formalmente por policondensación de un diácido con una diamina. La cantidad de átomos de carbono en las cadenas de la amina y del ácido se puede indicar detrás de los iniciales de poliamida. El más conocido, el PA6.6 es por lo tanto el producto formal del ácido hexanodioico (ácido adípico) y la hexametilenodiamina.
Por razones prácticas no se utiliza el ácido y la amina, sino soluciones de la amina y del cloruro del diácido. Entre las dos fases, se forma el polímero que puede ser expandido para dar el hilo de nailon.
Un polímero parecido es el perlón que se forma por apertura y polimerización de una lactama, generalmente la caprolactama. La diferencia reside en que en el nailon las cadenas están formadas por polímeros de la fórmula de general ( ..-NH-C(=O)-(CH2)n-C(=O)-NH-(CH2)m-...) mientras que en el perlón las cadenas tienen la secuencia ( ..-NH-C(=O)-(CH2)n-NH-C(=O)-(CH2)n-...).
El descubridor del nailon y quien lo patentó primeramente fue Wallace Hume Carothers. El descubrimiento fue el día 28 de febrero de 1935, pero no fue patentado hasta el 20 de septiembre de 1938 (U.S. Patents 2130523, 2130947 et 2130948). A la muerte de éste, la empresa DuPont conservó la patente. Los Laboratorios DuPont, en 1938, produjeron esta fibra sintética fuerte y elástica, que reemplazaría en parte a la seda y el rayón.
El nailon es una fibra textil elástica y resistente, no la ataca la polilla, no precisa planchado y se utiliza en la confección de medias, tejidos y telas de punto, también cerdas y sedales. El nailon moldeado se utiliza como material duro en la fabricación de diversos utensilios, como mangos de cepillos, peines, etc.
Con este invento, se revolucionó en 1938 el mercado de las medias, con la fabricación de las medias de nailon, pero pronto se hicieron muy difíciles de conseguir, porque al año siguiente los Estados Unidos entraron en la Segunda Guerra Mundial y el nailon fue necesario para hacer material de guerra, como cuerdas y paracaídas. Pero antes de las medias o de los paracaídas, el primer producto de nailon fue el cepillo de dientes con cerdas de nailon. Las primeras partidas llegaron a Europa en 1945.
Contenido
Etimología
Se cree que su nombre es un juego de palabras, haciendo referencia a NY (Nueva York) y Lon (Londres), dos ciudades que conjugadas en idioma inglés dan como resultado NyLon, ya que lo descubrirían dos investigadores que vivían uno en cada ciudad.
Según John W. Eckelberry (DuPont)[cita requerida], "nyl" es una sílaba elegida al azar y "on" es en inglés un sufijo de muchas fibras.
Otra versión dice que el nombre debería haber sido "no-run", indicando que las medias hechas por este material no se rompían con facilidad pero por razones jurídicas fue cambiado a Nylon.
Otra leyenda atribuye el nombre a abreviaciones de exclamaciones como "Now You Lousy Old Nipponese" (o "Now You Look Old Nippon" o "Now You Loose Old Nippon") en contra de los japoneses al tratarse de un sustituto de la seda que se había importado de China ocupada por los japoneses en la Segunda Guerra Mundial.
Propiedades
Durante la fabricación las fibras de nailon son sometidas a extrusión, texturizado e hilado en frío hasta alcanzar cerca de 4 veces su longitud original, lo cual aumenta su cristalinidad y resistencia a la tracción.
Resistencia
Resistencia Química Compuesto Valor Alcoholes Buena Cetonas Buena Grasas y Aceites Mala Halógenos Mala Hidrocarburos Aromáticos Buena Su viscosidad de fundido es muy baja, lo cual puede acarrear dificultades en la transformación industrial, y su exposición a la intemperie puede causar una fragilización y un cambio de color salvo si hay estabilización o protección previa.
Al nailon se le puede agregar fibra de vidrio para proporcionar un incremento en la rigidez.
Es un polímero cristalino ya que se le da un tiempo para que se organice y se enfríe lentamente, siendo por esto muy resistente.
Las cadenas de nailon con un número par de átomos de carbono entre los grupos amida son más compactas y sus puntos de fusión serán más altos que los nailons con un número impar de átomos de C. El punto de fusión disminuye y la resistencia al agua aumenta a medida que aumenta el número de grupos metileno entre los grupos amida.
Punto de fusión y solubilidad
El nailon es soluble en fenol, cresol y ácido fórmico. Su punto de fusión es de 263 °C.
Mecanismo de reacción
El nailon 6,6 tiene un monómero, que se repite n veces, cuanto sea necesario para dar forma a una fibra. El primer 6 que acompaña al nailon nos dice el número de carbonos de la amida y la segunda cifra es el número de carbonos de la cadena ácida.
El nailon 6,6 se sintetiza por condensación en el laboratorio a partir de cloruro de adipoílo y hexametilenodiamina. Pero en una planta industrial de nailon, se fabrica generalmente haciendo reaccionar el ácido adípico (derivado del fenol) con la hexametilenodiamina (derivado del amoniaco).
Cinética
Como el nailon se produce por condensación, la cinética es por pasos. Debido a que hay menos masa en el polímero que en los monómeros originales, decimos que el polímero está condensado con respecto a los monómeros. El subproducto es agua y se le denomina condensado.
Las polimerizaciones por condensación generan subproductos. Las polimerizaciones por adición, no.
Estructura
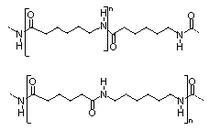
El nailon 6,6 es una estructura heterogénea ya que está conformado por C, H, CO, NH.
Estado
De acuerdo con la funcionalidad F=2, el nailon es una fibra, generalmente de alta densidad.
La organización de las moléculas y el enfriamiento cuidadoso con que se hace para este fin, determina que el polímero sea cristalino
Fuerzas moleculares
Las fuerzas moleculares del nailon son secundarias. Presenta fuerza de London (no polar) y múltiples puentes de hidrógeno, como se puede ver en la gráfica anterior.
Los enlaces por puente de hidrógeno y otras interacciones secundarias entre cadenas individuales, mantienen fuertemente unidas a las cadenas poliméricas. Tan fuerte, que éstas no apetecen particularmente deslizarse una sobre otra.
Esto significa que cuando usted estira las fibras de nailon, no se extienden mucho, si es que lo hacen. Lo cual explica por qué las fibras son ideales para emplearlas en hilos y sogas.
Bueno, en ese caso, creo que puedo decirle que las fibras también tienen sus inconvenientes. Si bien poseen buena fuerza tensil, es decir que son resistentes cuando se las estira, por lo general tienen baja fuerza compresional, o sea, son débiles cuando se aprietan o se comprimen. Además, las fibras tienden a ser resistentes en una dirección, la dirección en la cual están orientadas. Si se las estira en ángulos rectos a la dirección de su orientación, tienden a debilitarse.
Debido a esta extraña combinación de resistencias y debilidades, a menudo resulta una buena idea emplear las fibras juntamente con otro material, como un termorrígido.
Las fibras frecuentemente son usadas para reforzar los termorrígidos. Compensan las falencias de los termorrígidos y a su vez, las resistencias de los termorrígidos hacen lo propio con las falencias de las fibras.
Cuando un termorrígido o cualquier otro polímero es reforzado de este modo con una fibra, se dice que es un material compuesto.
Policondensación y etapas
El nailon se produce por medio de policondensación.
Cuando el oxígeno del carbonilo es protonado, se vuelve mucho más vulnerable al ataque del nitrógeno de nuestra diamina. Esto ocurre porque el oxígeno protonado porta una carga positiva.
Al oxígeno no le gusta tener una carga positiva. Entonces atrae hacia sí mismo los electrones que comparte con el carbonilo. Esto deja al carbono del carbonilo deficiente de electrones y listo para que el nitrógeno de la amina le done un par.
El dímero, si lo desea, también puede reaccionar con otros dímeros para formar un tetrámero. O puede reaccionar con un trímero para formar un pentámero y a su vez reaccionar con oligómeros más grandes.
Finalmente, cuando esto sucede, los dímeros se transforman en trímeros, tetrámeros y oligómeros más grandes y estos oligómeros reaccionan entre sí para formar oligómeros aún más grandes. Esto sigue así hasta que se hacen lo suficientemente grandes como para ser considerados polímeros
Para que las moléculas crezcan lo suficiente como para ser consideradas polímeros, tenemos que hacer esta reacción bajo vacío. En este caso, todo el subproducto agua se evaporará y será eliminado del medio de reacción. Debemos deshacernos del agua debido a una pequeña regla llamada Principio de Le Châtelier.
Como se dijo antes, la reacción no necesita un catalizador ácido para llevarse a cabo; La razón por la que se sabe esto, es que cuando nos acercamos al final de la polimerización, donde no hay muchos grupos ácidos remanentes para comportarse como catalizadores, la reacción aún prosigue.
Es decir, la amina puede reaccionar con los ácidos carboxílicos no protonados. Si no fuera así, no se podría obtener nailon 6,6 de alto peso molecular sin un catalizador externo, ya que la reacción se detendría a conversiones más altas, cuando no haya suficientes grupos ácidos para actuar como catalizadores. La materia prima para la producción de nailón 66 es el benceno, el cual se deriva del crackeo y de la reformación del petróleo
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre NailonCommons.
Wikimedia Commons alberga contenido multimedia sobre NailonCommons.
Categorías:- Poliamidas
- Fibras sintéticas
- Dieléctricos
Wikimedia foundation. 2010.