- Antiaromaticidad
-
Las moléculas con antiaromaticidad o pseudoaromaticidad son del tipo sistemas cíclicos, conteniendo enlaces alternativos simples y doble enlaces, donde la energía del electrón pi del compuesto antiaromático es mayor que aquel de su contrapartida de cadena abierta. Así, los compuestos antiaromáticos son inestables y altamente reactivos; frecuentemente esos compuestos antiaromáticos se distorsionan entre sí fuera de planaridad para intentar resolver esta inestabilidad. Los compuestos antiaromáticos usualmente fallan con la regla de Hückel de aromaticidad.
Ejemplos de sistemas antiaromáticos son el ciclobutadieno (A), el catión ciclopentadienil (B) y el anión ciclopropenil (C).
El ciclooctatetraeno es un sistema 4n, pero ni aromático o antiaromático debido a que las molécules escapan de la geometría plana.
Por adición o eliminación de un par de electrones vía una reacción redox, un sistema π puede convertirse en aromático y ser más estable que el compuesto original no- o antiaromático, por ej. el dianión ciclooctatetraenuro.
Los criterios de IUPAC para antiaromaticidad son los que siguen:[1]
- La molécula debe tener 4 n π electrones, donde n es cualquier número entero.
- La molécula debe ser cíclica.
- La molécula debe tener un sistema conjugado electrón pi.
- La molécula debe ser planar.
Sin embargo, muchos químicos acuerdan en la definición basada en empirismo (o en simulación) de observaciones energéticas.
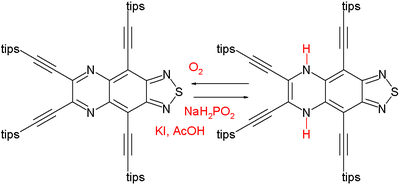
Se ha observado que la diferencia de energía entre los compuestos aromáticos y antiaromáticos disminuye al incrementarse el tamaño.[2] Por ej., el sistema 12-pi difenileno es un compuesto antiaromático pero estable y aún comercialmente disponible. La baja energía que penaliza la antiaromaticidad es también demostrada en el par pirazina - dihidropirazina:
El compuesto de la izq. es un aromático de 14 electrones (valor NICS -26,1 ppm) que puede ser reducido en una fuerte reacción exotérmica al compuesto antiaromático de 16 electrones (NICS +27,7 ppm) en la derecha.[3] La dihidropirazina lentamente convierte hacia atrás a la pirazina bajo la acción de oxígeno. Se muestra que otros factores de electrones pueden sobrepotenciar la aromaticidad.
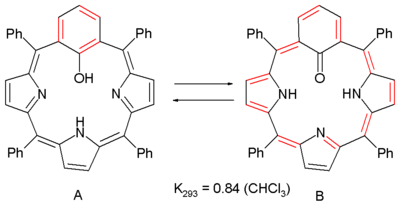
La antiaromaticidad también se observa en un equilibrio químico entre esas dos derivados de porfirina:[4]
Una porfirina regular es un compuesto aromático de 18 electrones (sin contar dos no-contribuyentes al doble puente) pero substituyendo un anillo pirrolico por un anillo de aromaticidad meta-fenileno. En este sistema el grupo fenileno is también un fenol y una estructura A se encuentra para interconvertir con 20 electrones antiaromaticos B vía tautomería ceto-enol.
La antiaromaticidad se evidencia por espectroscopía RMN con los protones internos NH cambiando bajando de 10 ppm a 21 ppm. Los valores NICS compara +0,7 para A (no-aromático) y +5 (antiaromático) para B y otro en experimentación in silico predice que B es realmente más estable que A.
Referencias
- ↑ Compendium of Chemical Terminology, Compuestos antiaromáticos (1 feb 2007.
- ↑ A Thiadiazole-Fused N,N-Dihydroquinoxaline: Antiaromatic but Isolable Shaobin Miao, Paul v. R. Schleyer, Judy I. Wu, Kenneth I. Hardcastle, and Uwe H. F. Bunz Org. Lett.; 2007; 9(6) pp 1073 - 1076; (Letter) doi 10.1021/ol070013i
- ↑ Reducing agent: Sodium hypophosphite, tips stands for triisopropylsilyl
- ↑ 22-Hydroxybenziporphyrin: Switching of Antiaromaticity by Phenol-Keto Tautomerization Marcin Stpie, Lechosaw Latos-Grayski, and Ludmia Szterenberg J. Org. Chem.; 2007; 72(7) pp 2259 - 2270; (Article) doi 10.1021/jo0623437
Wikimedia foundation. 2010.