- Anticuerpo de cadena sencilla
-
Anticuerpo de cadena sencilla
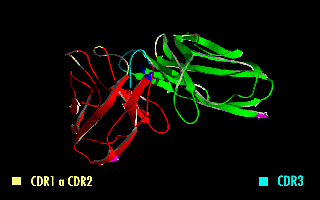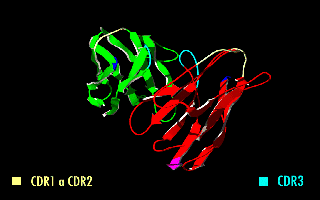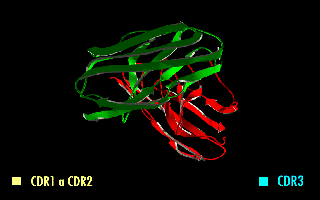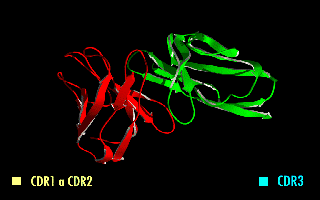 Estructura en rotación de un fragmento scFv en el que se destacan las regiones determinantes de la complementariedad (CDR).
Estructura en rotación de un fragmento scFv en el que se destacan las regiones determinantes de la complementariedad (CDR).
Un anticuerpo monocatenario, fragmento Fv monocatenario o scFv es la fusión de las regiones variables de las cadenas pesada y ligera de las inmunoglobulinas, unidas mediante un puente corto, que habitualmente está formado por serinas o glicinas.
Esta molécula quimérica mantiene la especificidad de la inmunoglobulina original, a pesar de la eliminación de las regiones constantes y la introducción de un péptido puente. La imagen de la derecha muestra cómo estas modificaciones dejan inalterada la estructura de la región del anticuerpo que reconoce el antígeno.
Estas moléculas se crearon originalmente para facilitar la confección de bibliotecas de expresión en fago (phage display) donde es muy conveniente expresar el dominio de unión a antígeno como un único péptido. Por otra parte, los scFv se pueden crear directamente a partir de cadenas ligeras y pesadas subclonadas, derivadas de un hibridoma.
Los scFv tienen muchas aplicaciones, como la citometría de flujo, la inmunohistoquímica y como dominios de unión a antígeno de receptores artificiales de linfocitos T.
Purificación de los scFv
Los fragmentos variables monocatenarios carecen de la región constante Fc que se encuentra en las moléculas de anticuerpo completas y, por ello, de los lugares de anclaje habituales utilizados para purificarlos (p. ej., utilizando proteína A/G). Estos fragmentos pueden purificarse o inmovilizarse utilizando Proteína L, ya que ésta interacciona con la región variable de las cadenas ligeras kappa.
Referencias
- Lennard, S (2001). «Standard Protocols for the Construction of scFv Libraries» Springer protocols. DOI 10.1385/1-59259-240-6:059.
Categoría: Inmunología
Wikimedia foundation. 2010.
